Rabu, 27 April 2011
Raul: Semua Masih Bisa Terjadi di Leg Kedua
Penyerang Schalke Raul Gonzales masih yakin timnya akan mampu lolos ke final Liga Champions meski di leg pertama takluk dari Manchester United. Menurut Raul, semua masih akan bisa terjadi di leg kedua di Old Trafford.
Schalke harus bertekuk lutut dari MU setelah menelan kekalahan di leg pertama semifinal Liga Champions di kandang mereka di Veltins Arena, Rabu (27/4) dini hari WIB. Dua gol dari Ryan Giggs dan Wayne Rooney membuat MU menang 2-0 dan mengantongi modal yang cukup berharga saat menjamu Schalke di leg kedua.
Meski terbilang cukup berat, Raul tetap optimis timnya mampu membalikkan keadaan di Old Trafford. Mantan penyerang Real Madrid tersebut yakin sesuatu masih bisa terjadi di leg kedua.
"Di leg kedua, semuanya masih akan mungkin terjadi. Kami tidak tahu apa yang akan terjadi, kami yang akan menerima hukuman atau kami yang akan mengantar mereka pulang. Tidak ada yang mustahil dalam sepakbola," tukas Raul kepada wartawan usai pertandingan seperti dilansir goal.com, Rabu.
"Kami mengharapkan hasil yang berbeda, hasil lain dalam pertandingan, tetapi kami masih senang karena kami bermain di level kami. Masalahnya adalah bahwa Manchester United bermain di level yang lain," ujar penyerang 33 tahun tersebut.
"Satu-satunya penyesalan yang kami hadapi adalah bahwa kami tidak membuat cukup peluang dalam mencetak gol dan kami harus kebobolan dua gol dalam dua menit. Mencapai semifinal untuk klub ini telah memberikan kebanggan yang besar kepada para pendukung," tandas pemain yang telah merasakan tiga gelar Liga Champions bersama Real madrid tersebut.
Schalke akan bertandang ke markas MU di Old Trafford pada 5 Mei. Mereka harus menang minimal dengan selisih 3-0 untuk bisa lolos ke final. Sedangkan bagi MU, hasil imbang saja sudah bisa meloloskan skuat Alex Ferguson tersebut ke final yang akan digelar di Stadion Wembley.(PJ/X-12)
Share | Read More..
Selasa, 26 April 2011
10 Fakta Menarik Schalke Vs Manchester United
Manchester United akan coba mengakhiri rekor buruk tak pernah menang melawan tim-tim Jerman di laga tandang Liga Champions. MU akan
melakukannya di semifinal leg 1 Liga Champions melawan wakil Jerman yang tersisa, Schalke di Veltins Arena, Selasa 25 April 2011 (Rabu dini hari
WIB).
Manajer MU, Sir Alex Ferguson tentu tahu betapa beratnya laga ini. Schalke punya rekor kandang bagus di Liga Champions musim ini. Sir
Alex siap menurunkan kekuatan terbaiknya, termasuk bek tengah tangguh sekaligus kapten MU, Nemanja Vidic yang disimpan di laga terakhir Liga Inggris (Premier League) saat mengalahkan Everton 1-0.
Sebelum menyaksikan laga menarik ini, berikut fakta-fakta menarik laga ini seperti dihimpun Yahoo:
1. Schalke selalu menang di semua laga kandangnya di Liga Champions musim ini.
2. Striker Schalke, Raul Gonzalez telah memenangkan Liga Champions tiga kali bersama Real Madrid. Jumlah itu sama dengan raihan total trofi juara MU di Liga Champoins.
3. Ini penampilan perdana Schalke di semifinal Liga Champions sekaligus pertemuan pertama dengan Manchester United.
4. Schalke kini berada di posisi 10 klasemen Liga Jerman (Bundesliga), tertinggal 29 poin di belakang pimpinan klasemen sementara Borussia Dortmund.
5. Tim asuhan Ralf Rangnick ini menjalani pemanasan jelang semifinal dengan kekalahan 0-1 di kandang dari Kaiserslautern di Bundesliga.
6. Manchester United tak pernah kebobolan dalam laga tandangnya di Liga Champions musim ini. MU menang empat kali dan seri sekali dalam lima
laga tandang.
7. Ryan Giggs menjadi pemain tersisa Manchester United yang menjadi juara Liga Champions 1999 dengan menaklukkan wakil Jerman, Bayern Munich 2-1 lewat gol di injury time Ole Gunnar Solskjaer dan Teddy Sheringham. Selain Giggs sebenarnya masih ada Paul Scholes, tapi ia absen di final di Camp Nou itu.
8. Setan Merah belum pernah menang agregat dua leg melawan wakil Jerman. MU kalah empat kali, terakhir melawan Bayern Munich di perempat
final musim lalu.
9. Michael Owen mencetak hattrick dalam penampilan terakhir di tanah Jerman. Owen memborong semua gol kemenangan MU saat menaklukkan
Wolfsburg 3-1 di fase grup musim lalu.
10. Sir Alex Ferguson telah memimpin MU dalam enam semifinal Liga Champions. Rekornya, menang tiga kali dan kalah tiga kali.
PREDIKSI SUSUNAN PEMAIN
Schalke (4-4-2): Neuer; Uchida, Metzelder, Howedes, Sarpei; Baumjohann, Matip, Papadopoulos, Jurado; Edu, Raul.
Manchester United (4-4-2): Van der Sar; Rafael, Ferdinand, Vidic, Evra; Nani, Carrick, Giggs, Park; Rooney, Hernandez. Read More..
Prediksi Semifinal Liga Champions 2010/2011: Real Madrid vs Barcelona
MASIH ada dua laga El Clasico yang bakal disuguhkan dua rival abadi, Real Madrid dan Barcelona. Tapi, kali ini bentrok keduanya terjadi di semifinal Liga Champions.
Pertemuan keduanya sebenarnya sudah bisa diprediksi sejak babak perempatfinal. Ketika itu, Barca tak mendapat kesulitan membekuk Shakhtar Donetsk. Sementara Los Blancos pun mengubur mimpi tim penuh kejutan Tottenham Hotspur untuk melangkah lebih jauh.
Pada semifinal leg pertama, Madrid akan lebih dulu berlaku sebagai tuan rumah. Sejak kehadiran Pep Guardiola di skuad senior Azulgrana, Los Blancos dibuat tak berdaya. Selama tiga musim terakhir, pertemuan kedua tim di La Liga selalu dimenangkan Barcelona.
Namun, peta kekuatan sedikit berubah musim ini. Masuknya Jose Mourinho mendampingi Iker Casillas dkk seperti angin segar. Memang, Mou dipermalukan Barca lima gol tanpa balas pada El Clasico pertama musim ini. Tapi, setelah itu kekuatan keduanya terlihat imbang.
Barca ditahan imbang 1-1 di Santiago Bernabeu pada El Clasico kedua. Setelah itu, Madrid membungkam Azulgrana pada partai final Copa del Rey memalui gol tunggal Cristiano Ronaldo di masa perpanjangan waktu.
Dua hasil ini jelas melecut semangat Madrid untuk tidak kembali dipecundangi rival utama mereka. Tensi tinggi akan kembali terhampar di dua leg semifinal. Pasalnya, laga ini tak sekadar untuk mempertaruhkan nama baik tapi juga sebagai langkah awal perebutan gelar di Eropa.
Masing-masing klub berambisi menyabet double winners musim ini. Jika Barca hampir pasti menjadi kampiun di La Liga, maka lolos ke final akan mempermudah jalan mereka untuk mengawinkan gelar. Sementara Los Blancos justru lebih dulu mengunci satu gelar Copa del Rey.
Akan sulit memprediksi siapa pemenangan pertandingan di Santiago Bernabeu, Kamis (28/4/2011) karena kedua tim memiliki kekuatan sama. Tapi, Madrid memiliki semangat lebih pascakemenangan Piala Raja.
Rekor Pertemuan
Copa del Rey 20 April 2011 Barcelona 0 - 1 Real Madrid
La Liga 6 April 2011 Real Madrid 1 - 1 Barcelona
La Liga 29 November 2010 Barcelona 5 - 0 Real Madrid
La Liga 10 April 2010 Real Madrid 0 - 2 Barcelona
La Liga 29 November 2009 Barcelona 1 - 0 Real Madrid
La Liga 02 Mei 2009 Real Madrid 2 - 6 Barcelona
La Liga 13 Desember 2008 Barcelona 2 - 0 Real Madrid
La Liga 07Mei 2008 Real Madrid 4 - 1 Barcelona
La Liga 23 Desember 2007 Barcelona 0 - 1 Real Madrid Read More..
Senin, 25 April 2011
Trichomoniasis akibat dari Trichomonas vaginalis
artikel tentang "Trichomoniasis akibat dari Trichomonas vaginalis" telah di pindahkan ke halaman yang lain disini
Read More..
Teknik pewarnaan mikroorganisme
BAB I
PENDAHULUAN
I.1 Latar Belakang
Mikroorganisme yang ada di alam ini mempunyai morfologi, struktur dan sifat-sifat yang khas, begitu pula dengan bakteri. Bakteri yang hidup hampir tidak berwarna dan kontras dengan air, dimana sel-sel bakteri tersebut disuspensikan. Salah satu cara untuk mengamati bentuk sel bakteri sehingga mudah untuk diidentifikasi ialah dengan metode pengecatan atau pewarnaan. Hal tersebut juga berfungsi untuk mengetahui sifat fisiologisnya yaitu mengetahui reaksi dinding sel bakteri melalui serangkaian pengecatan (Jimmo, 2008).
Berbagai macam tipe morfologi bakteri (kokus, basil, spirilum, dan sebagainya) dapat dibedakan dengan menggunakan pewarna sederhana. Istilah ”pewarna sederhana” dapat diartikan dalam mewarnai sel-sel bakteri hanya digunakan satu macam zat warna saja (Gupte, 1990). Kebanyakan bakteri mudah bereaksi dengan pewarna-pewarna sederhana karena sitoplasmanya bersifat basofilik (suka akan basa) sedangkan zat-zat warna yang digunakan untuk pewarnaan sederhana umumnya bersifat alkalin (komponen kromoforiknya bermuatan positif). Faktor-faktor yang mempengaruhi pewarnaan bakteri yaitu fiksasi, peluntur warna , substrat, intensifikasi pewarnaan dan penggunaan zat warna penutup. Suatu preparat yang sudah meresap suatu zat warna, kemudian dicuci dengan asam encer maka semua zat warna terhapus. sebaliknya terdapat juga preparat yang tahan terhadap asam encer. Bakteri-bakteri seperti ini dinamakan bakteri tahan asam, dan hal ini merupakan ciri yang khas bagi suatu spesies (Dwidjoseputro, 1994).
Berdasarkan hal tersebut di atas, maka dilakukanlah praktikum ini untuk mengetahui teknik pewarnaan mikroorganisme baik itu dengan cara pengecatan sederhana, pengecatan negatif maupun pengecatan gram serta mengetahui morfologi mikroorganisme.
I.2 Tujuan Percobaan
Adapun tujuan dari percobaan ini adalah :
1. Untuk mengetahui teknik pewarnaan mikroorganisme dengan cara pengecatan negatif, pengecatan sederhana dan pengecatan gram.
2. Untuk mengetahui morfologi mikroorganisme
I.3 Waktu dan Tempat Percobaan
Praktikum ini dilaksanakan pada hari Rabu, 25 Maret 2009, pukul 14.00- 17.30 WITA dan bertempat di Laboratorium Mikrobiologi, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin, Makassar.
BAB II
TINJAUAN PUSTAKA
Melihat dan mengamati bakteri dalam keadaan hidup sangat sulit, kerena selain bakteri itu tidak berwarna juga transparan dan sangat kecil. Untuk mengatasi hal tersebut maka dikembangkan suatu teknik pewarnaan sel bekteri, sehingga sel dapat terlihat jelas dan mudah diamati. Olek karena itu teknik pewarnaan sel bakteri ini merupakan salahsatu cara yang paling utama dalam penelitian-penelitian mikrobiologi (Rizki, 2008).
Macam-macam pewarnaan (Yulneriwanti, 2008) :
1. Pewarnaan negatif
- Bakteri tidak diwarnai, tapi mewarnai latar belakang
- Ditujukan untuk bakteri yang sulit diwarnai, seperti spirochaeta
2. Pewarnaan sedehana
- Menggunakan satu macam zat warna (biru metilen/air fukhsin)
- Tujuan hanya untuk melihat bentuk sel
3. Pewarnaan diferensial
- menggunakan lebih dari satu macam zat warna
- Tujuan untuk membedakan antar bakteri
- Contoh: Pw. Gram, Pw. Bakteri Tahan Asam
4. Pewarnaan khusus
- Untuk mewarnai struktur khusus/tertentu dari bakteri→ kapsul, spora, flagel dll
Cara pewarnaan negatif
- Sediaan hapus → teteskan emersi → lihat dimikroskop
Untuk mempelajari morfologi, struktur, sifat-sifat bakteri dalam membantu mengidentifikasinya, kuman perlu diwarnai.
Pewarnaan Gram atau metode Gram adalah suatu metode empiris untuk membedakan spesies bakteri menjadi dua kelompok besar, yakni gram-positif dan gram-negatif, berdasarkan sifat kimia dan fisik dinding sel mereka. Metode ini diberi nama berdasarkan penemunya, ilmuwan Denmark Hans Christian Gram (1853–1938) yang mengembangkan teknik ini pada tahun 1884 untuk membedakan antara pneumokokus dan bakteri Klebsiella pneumoniae (filzahazny, 2008).
Bakteri Gram-negatif adalah bakteri yang tidak mempertahankan zat warna metil ungu pada metode pewarnaan Gram. Bakteri gram-positif akan mempertahankan zat warna metil ungu gelap setelah dicuci dengan alkohol, sementara bakteri gram-negatif tidak. Pada uji pewarnaan Gram, suatu pewarna penimbal (counterstain) ditambahkan setelah metil ungu, yang membuat semua bakteri gram-negatif menjadi berwarna merah atau merah muda. Pengujian ini berguna untuk mengklasifikasikan kedua tipe bakteri ini berdasarkan perbedaan struktur dinding sel mereka (filzahazny, 2008).
Sifat bakteri terhadap pewarnaan Gram merupakan sifat penting untuk membantu determinasi suatu bakteri. Beberapa perbedaan sifat yang dapat dijumpai antara bakteri Gram positif dan bakteri Gram negatif dapat dilihat pada table berikut ini (filzahazny, 2008) :
Bakteri Gram Positif Bakteri Gram Negatif
Dinding Sel:
Lapisan petidoglikan Lebih tebal Lebih tipis
Kadar lipid 1-4% 11-22%
Resistensi terhadap alkali (1% KOH)
Lebih pekat Larut
Kepekaan terhadap Yodium Lebih peka Kurang peka
Toksin yang dibentuk Eksotoksin Endotoksin
Resistensi terhadap tellurit Lebih tahan Lebih peka
Sifat tahan asam Ada yang tahan asam Tidak ada yang tahan asam
Kepekaan terhadap penisilin Lebih peka Kurang peka
Kepekaan terhadap streptomisin Tidak peka Peka
Teknik pewarnaan
Pewarnaan sederhana, merupakan pewarna yang paling umum digunakan. Disebut demikian karena hanya digunakan satu jenis cat pewarna untuk mewarnai organisme. Kebanyakan bakteri telah bereaksi dengan pewarna-pewarna sederhana karena sitoplasmanya bersifat basofil (suka akan basa). Zat-zat warna yang digunakan untuk pewarnaan sederhana umumnya bersifat alkalin (komponen kromofornya bersifat positif). Pewarnaan sederhana ini memungkinkan dibedakannya bakteri dengan bermacam-macam tipe morfologi (coccus, vibrio, basillus, dsb) dari bahan-bahan lainnya yang ada pasa olesan yang diwarnai (Hadiotomo, 1990).
Pewarnaan negatif, metode ini bukan untuk mewarnai bakteri tetapi mewarnai latar belakangnya menjadi hitam gelap. Pada pewarnaan ini mikroorganisme kelihatan transparan (tembus pandang). Teknik ini berguna untuk menentukan morfologi dan ukuran sel. Pada pewarnaan ini olesan tidak mengalami pemanasan atau perlakuan yang keras dengan bahan-bahan kimia, maka terjadinya penyusutan dan salah satu bentuk agar kurang sehingga penentuan sel dapat diperoleh dengan lebih tepat. Metode ini menggunakan cat nigrosin atau tinta cina (Hadiotomo, 1990).
Struktur di dalam sel pada tempat-tempat yang khas dibentuk oleh spesies ini disebut endospora. Endospora dapat bertahan hidup dalam keadaan kekurangan nutrien, tahan terhadap panas, kekeringan, radiasi UV serta bahan-bahan kimia. Ketahanan tersebut disebabkan oleh adanya selubung spora yang tebal dan keras. Sifat-sifat ini menyebabkan dibutuhkannya perlakuan yang keras untuk mewarnainya. Hanya bila diperlukan panas yang cukup, pewarna yang sesuai dapat menembus endospora. Tetapi sekali pewarna memasuki endospora, sukar untuk dihilangkan. Ukuran dan letak endospora di dalam sel merupakan ciri-ciri yang digunakan untuk membedakan spesies-spesies bakteri yang Membentuknya (Dwidjoseputro, 1989).
Ciri-ciri bakteri gram negatif yaitu (Hadiotomo, 1990) :
- Struktur dinding selnya tipis, sekitar 10 – 15 mm, berlapis tiga atau multilayer.
- Dinding selnya mengandung lemak lebih banyak (11-22%), peptidoglikan terdapat didalam lapisan kaku, sebelah dalam dengan jumlah sedikit 10% dari berat kering, tidak mengandung asam tekoat.
- Kurang rentan terhadap senyawa penisilin.
- Pertumbuhannya tidak begitu dihambat oleh zat warna dasar misalnya kristal violet.
- Komposisi nutrisi yang dibutuhkan relatif sederhana.
- Tidak resisten terhadap gangguan fisik.
Ciri-ciri bakteri gram positif yaitu (Hadiotomo, 1990) :
- Struktur dinding selnya tebal, sekitar 15-80 nm, berlapis tunggal atau monolayer.
- Dinding selnya mengandung lipid yang lebih normal (1-4%), peptidoglikan ada yang sebagai lapisan tunggal. Komponen utama merupakan lebih dari 50% berat ringan. Mengandung asam tekoat.
- Bersifat lebih rentan terhadap penisilin.
- Pertumbuhan dihambat secara nyata oleh zat-zat warna seperti ungu kristal.
- Komposisi nutrisi yang dibutuhkan lebih rumit.
- Lebih resisten terhadap gangguan fisik.
Pengecatan gram dilakukan dalam 4 tahap yaitu (Volk & Wesley, 1998):
1. Pemberian cat warna utama (cairan kristal violet) berwarna ungu.
2. Pengintesifan cat utama dengan penambahan larutan mordan JKJ.
3. Pencucian (dekolarisasi) dengan larutan alkohol asam.
4. Pemberian cat lawan yaitu cat warna safranin
BAB III
METODOLOGI
III. 1 Alat
Alat yang digunakan pada percobaan ini adalah mikroskop, objek gelas, ose bulat, gegep kayu,lampu spritus , korek api,pipet tetes,wadah baskom, botol semprot , dan hand sprayer
III.2 Bahan
Bahan yang digunakan pada percobaan ini adalah Aquadest steri, lBiakan Eschericia coli, Biakan Bacillus cereus, Biakan Salmonella typii, Gram A (Kristal violet), Gram B (larutan lugol), Gram C (Alkohol asam), Gram D (Safranin), Minyak imersi, Tissue roll, Alcohol 70 %, Spirtus, Larutan nigrosin (tinta cina).
III.3 Prosedur Kerja
A. Pengecatan Sederhana
1. Membuat preparat olesan bakteri Bacillus cereus dan Salmonella typii lalu fiksasi dengan pembakar spirtus.
2. Meneteskan larutan Kristal violet diatas olesan preparat tersebut sebanyak 1-2 tetes dan membiarakan selama 1-2 menit.
3. Mencuci dengan air mengalir sampai sisa cat tercuci habis, kemudian mengeringkan dengan hati-hati mengunakan tissue roll.
4. Mengamati dibawah mikroskop dengan menggunakan pembesaran 100x dan minyak imersi.
5. Menggambar dan mencatat hasil yang diamati.
B. Pengecatan Negatif
1. Membersihkan gelas objek dengan alcohol 70 % agar bebas lemak.
2. Mengambil 1 ose yang digunakan umntuk mengambil biakan, meletakkan biakan pada objek gelas kemudian mencampur dengan 1-2 tetes nigrosin.
3. Dengan menggunakan objek gelas lain menyentuhkan sisi objek gelas tersebut pada sampel tersebut sehingga membentuk sudut 300C, selanjutnya menarik objek gelas tersebut dengan arah yang berlawanan hingga membentuk film tipis.
4. Membiarkan hingga mengering lalu mengamati diubawah mikroskop dengan pembesaran 100x dan menggunakan minyak imersi.
5. Menggambar dan mencatat hasil pengamatan.
C. Pengecatan Gram
1. Menyiapkan preparat olesan bakteri Bacillus cereus, Eshcericia coli dan Salmonella typii lalu fiksasi pada pembakar spirtus.
2. Meneteskan larutan gram A sebanyak 2-3 tetes pada olesan bakteri, membiarkan selama 1 menit.
3. Mencuci dengan air mengalir dan mengeringkan dengan tissue roll dengan hati-hati.
4. Meneteskan larutan gram B, membiarkan selama 1 menit.
5. Mencuvi dengan air dan keringkan.
6. Meneteskan larutan gram C, membiarkan selama 30 detik.
7. Mencuci dengan air dan keringkan.
8. Menetesi dengan larutan gram D, membiarkan selama 30 detik, mencuci dengan air dan mengeringkan dengan tissue.
9. Mengamati dibawah mikroskop dengan pembesaran 100x dan menggunakan minyak imersi
BAB IV
HASIL DAN PEMBAHASAN
IV.1 Hasil
IV.2 Pembahasan
A. Pengecatan Sederhana
Pengecatan sederhana digunakan untuk memperlihatkan atau memperjelas kontras antara sel dan latar belakangnya sehingga dapat mempertajam bentuk dari sel-sel mikroba itu sendiri, dengan cara mewarnai sel-sel mikroba dengan zat warna khususnya warna Kristal violet. Pada pengecatan sederhana digunakan bakteri Bacillus cereus dan Salmonella typii. Setelah pengecatan diperoleh bakteri tersebut berwarna ungu, yang berarti bakteri tersebut menyerap zat warna cat tersebut sehingga Nampak pada mikroskop. Zat warna yang umunya digunakan yakni yang bersifat alkalin (kromatofornya bermuatan +).
B. Pengecatan Negatif
Pada pengecatan ini digunakan cat asam nirosin (tinta cina). Pengecatan ini dilakukan untuk mewarnai latar belakang preparat sedangkan bakteri sendiri tidak terwarnai serta untuk mengamati ukuran, bentuk, dan tata letak sel. Setelah pengamatan dibawah mikroskop diperoleh preparat mikroba berwarna hitam sedangkan bakteri sendiri tidak berwarna (berwarna putih) dan berbentuk basil (batang).
C. Pengecatan Gram
Pengecatan gram termasuk pengecatan diferensial yang digunakan untuk membedakan bakteri gram negative dan bakteri gram positif. Pada pengecatn ini digunakan 3 jenis bakteri yaitu Bacillus cereus, Salmonella typii dan Eshericia coli.. Pengecatan ini menggunakan 4 jenis larutan yaitu Kristal violet sebagai cat utama, larutan iodine sebagai pengintensifan cat utama, alcohol asam untuk pencucian dan safranin sebagai cat penutup. Berdasarkan percobaan diperoleh Bacillus cereus dan Salmonella typii bersifat gram positif yang berarti bakteri dapat mengikat dengan kuat cat utama cristal violet berwarna ungu, pada saat bakteri Gram positif ditambahkan dengan kristal violet maka gram positif akan mengabsorbsi larutan tersebut hanya pada dinding sel, dengan pemberian larutan lugol maka kristal violet akan masuk sampai ke inti sel, pemberian alkohol menyebabkan pori-pori dinding sel mengecil sehingga warna ungu tertahan di dalam sel disebabkan oleh rendahnya kandungan lipid. Sedangkan bakteri Eschericia coli bersifat gram negative karena tidak dapat mengikat kuat cat utama dan dapat diwarnai oleh cat lawan yakni merah dari pewarna safranin.
Perbedaan gram (+) dan gram (-)
Sifat Gram (+) Gram (-)
• Komposisi Kandungan lipid rendah Kandungan lipid tinggi
• Ketahanan terhadap penisilin Lebih sensitif Lebih tahan
• Penghambatan warna Lebih dihambat Kurang dihambat
• Ketahanan terhadap fisik Lebih tahan Kurang tahan
• Kebutuhan Nutrien Kompleks Relatif
BAB V
PENUTUP
V.1 Kesimpulan
Berdasarkan percobaan yang dilakukan maka dapat disimpulkan bahwa :
- Pewarnaan mikroorganisme dapat dilakukan dengan cara yaitu dengan pengecatan gram, pengecatan sederhana dan pengecatan negative.
- Pewarnaan sederhana digunakan untuk melihat bentuk dan struktur sel bakteri dengan menggunakan satu jenis pewarna seperti safranin atau kristal violet, pewarnaan gram digunakan untuk membedakan antara bakteri gram (+) dan gram (-) dengan lebih dari satu zat warna sedangkan pewarnaan negative berguna untuk mewarnai latar belakang preparat dan bakteri sendiri tidak terwarnai.
- Bakteri gram negatif pada teknik pewarnaan akan menghasilkan warna merah dan bakteri gram positif akan menghasilkan warna ungu.
V.2 Saran
Saran untuk laboratorium agar percobaan berikutnya keanekaragaman bakteri yang digunakan dapat bertambah lagi sehingga hasil yang diperoleh dapat bervariasi.
DAFTAR PUSTAKA
Dwidjoseputro, D., 1989. Dasar-Dasar Mikrobiologi. Malang : Djambatan.
Hadiotomo, Ratna Siri., 1990. Mikrobiologi Dasar Dalam Praktek. Jakarta : Pt Gramedia.
Jimmo., 2008, http ://Pembuatan PReParAT dan PengeCaTAnnyA _ BLoG KiTa.mht,. diakses pada tanggal 14 April 2009, Makassar.
Fauziah., 2008, www.fkugm2008.com/wp-content/uploads/HSC/1- 2x/6/Praktikum6.pdf. diakses pada tangan 04 April 2009, Makassar.
Filzahazny., 2008, , http:/wordpress.com/Penganta-tentang-bakteri.htm.di akses pada tanggal 08 maret 2009, Makassar.
Rizki., 2008, http ://ngecat bakterimakul-rizki.blogspot.com/2008/02/materi- kuliah.html. diakses pada tanggal 04 April 2009, Makassar.
Volk, Wesley A dan Margareth F. Wheeler., 1998. Mikrobiologi Dasar Jilid I. Jakarta : Erlangga.
Yulneriwanti., 2008, http://01-bakteri.html. diakses pada tanggal 08 Maret 2009. Makassar.
Read More..
PENDAHULUAN
I.1 Latar Belakang
Mikroorganisme yang ada di alam ini mempunyai morfologi, struktur dan sifat-sifat yang khas, begitu pula dengan bakteri. Bakteri yang hidup hampir tidak berwarna dan kontras dengan air, dimana sel-sel bakteri tersebut disuspensikan. Salah satu cara untuk mengamati bentuk sel bakteri sehingga mudah untuk diidentifikasi ialah dengan metode pengecatan atau pewarnaan. Hal tersebut juga berfungsi untuk mengetahui sifat fisiologisnya yaitu mengetahui reaksi dinding sel bakteri melalui serangkaian pengecatan (Jimmo, 2008).
Berbagai macam tipe morfologi bakteri (kokus, basil, spirilum, dan sebagainya) dapat dibedakan dengan menggunakan pewarna sederhana. Istilah ”pewarna sederhana” dapat diartikan dalam mewarnai sel-sel bakteri hanya digunakan satu macam zat warna saja (Gupte, 1990). Kebanyakan bakteri mudah bereaksi dengan pewarna-pewarna sederhana karena sitoplasmanya bersifat basofilik (suka akan basa) sedangkan zat-zat warna yang digunakan untuk pewarnaan sederhana umumnya bersifat alkalin (komponen kromoforiknya bermuatan positif). Faktor-faktor yang mempengaruhi pewarnaan bakteri yaitu fiksasi, peluntur warna , substrat, intensifikasi pewarnaan dan penggunaan zat warna penutup. Suatu preparat yang sudah meresap suatu zat warna, kemudian dicuci dengan asam encer maka semua zat warna terhapus. sebaliknya terdapat juga preparat yang tahan terhadap asam encer. Bakteri-bakteri seperti ini dinamakan bakteri tahan asam, dan hal ini merupakan ciri yang khas bagi suatu spesies (Dwidjoseputro, 1994).
Berdasarkan hal tersebut di atas, maka dilakukanlah praktikum ini untuk mengetahui teknik pewarnaan mikroorganisme baik itu dengan cara pengecatan sederhana, pengecatan negatif maupun pengecatan gram serta mengetahui morfologi mikroorganisme.
I.2 Tujuan Percobaan
Adapun tujuan dari percobaan ini adalah :
1. Untuk mengetahui teknik pewarnaan mikroorganisme dengan cara pengecatan negatif, pengecatan sederhana dan pengecatan gram.
2. Untuk mengetahui morfologi mikroorganisme
I.3 Waktu dan Tempat Percobaan
Praktikum ini dilaksanakan pada hari Rabu, 25 Maret 2009, pukul 14.00- 17.30 WITA dan bertempat di Laboratorium Mikrobiologi, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin, Makassar.
BAB II
TINJAUAN PUSTAKA
Melihat dan mengamati bakteri dalam keadaan hidup sangat sulit, kerena selain bakteri itu tidak berwarna juga transparan dan sangat kecil. Untuk mengatasi hal tersebut maka dikembangkan suatu teknik pewarnaan sel bekteri, sehingga sel dapat terlihat jelas dan mudah diamati. Olek karena itu teknik pewarnaan sel bakteri ini merupakan salahsatu cara yang paling utama dalam penelitian-penelitian mikrobiologi (Rizki, 2008).
Macam-macam pewarnaan (Yulneriwanti, 2008) :
1. Pewarnaan negatif
- Bakteri tidak diwarnai, tapi mewarnai latar belakang
- Ditujukan untuk bakteri yang sulit diwarnai, seperti spirochaeta
2. Pewarnaan sedehana
- Menggunakan satu macam zat warna (biru metilen/air fukhsin)
- Tujuan hanya untuk melihat bentuk sel
3. Pewarnaan diferensial
- menggunakan lebih dari satu macam zat warna
- Tujuan untuk membedakan antar bakteri
- Contoh: Pw. Gram, Pw. Bakteri Tahan Asam
4. Pewarnaan khusus
- Untuk mewarnai struktur khusus/tertentu dari bakteri→ kapsul, spora, flagel dll
Cara pewarnaan negatif
- Sediaan hapus → teteskan emersi → lihat dimikroskop
Untuk mempelajari morfologi, struktur, sifat-sifat bakteri dalam membantu mengidentifikasinya, kuman perlu diwarnai.
Pewarnaan Gram atau metode Gram adalah suatu metode empiris untuk membedakan spesies bakteri menjadi dua kelompok besar, yakni gram-positif dan gram-negatif, berdasarkan sifat kimia dan fisik dinding sel mereka. Metode ini diberi nama berdasarkan penemunya, ilmuwan Denmark Hans Christian Gram (1853–1938) yang mengembangkan teknik ini pada tahun 1884 untuk membedakan antara pneumokokus dan bakteri Klebsiella pneumoniae (filzahazny, 2008).
Bakteri Gram-negatif adalah bakteri yang tidak mempertahankan zat warna metil ungu pada metode pewarnaan Gram. Bakteri gram-positif akan mempertahankan zat warna metil ungu gelap setelah dicuci dengan alkohol, sementara bakteri gram-negatif tidak. Pada uji pewarnaan Gram, suatu pewarna penimbal (counterstain) ditambahkan setelah metil ungu, yang membuat semua bakteri gram-negatif menjadi berwarna merah atau merah muda. Pengujian ini berguna untuk mengklasifikasikan kedua tipe bakteri ini berdasarkan perbedaan struktur dinding sel mereka (filzahazny, 2008).
Sifat bakteri terhadap pewarnaan Gram merupakan sifat penting untuk membantu determinasi suatu bakteri. Beberapa perbedaan sifat yang dapat dijumpai antara bakteri Gram positif dan bakteri Gram negatif dapat dilihat pada table berikut ini (filzahazny, 2008) :
Bakteri Gram Positif Bakteri Gram Negatif
Dinding Sel:
Lapisan petidoglikan Lebih tebal Lebih tipis
Kadar lipid 1-4% 11-22%
Resistensi terhadap alkali (1% KOH)
Lebih pekat Larut
Kepekaan terhadap Yodium Lebih peka Kurang peka
Toksin yang dibentuk Eksotoksin Endotoksin
Resistensi terhadap tellurit Lebih tahan Lebih peka
Sifat tahan asam Ada yang tahan asam Tidak ada yang tahan asam
Kepekaan terhadap penisilin Lebih peka Kurang peka
Kepekaan terhadap streptomisin Tidak peka Peka
Teknik pewarnaan
Pewarnaan sederhana, merupakan pewarna yang paling umum digunakan. Disebut demikian karena hanya digunakan satu jenis cat pewarna untuk mewarnai organisme. Kebanyakan bakteri telah bereaksi dengan pewarna-pewarna sederhana karena sitoplasmanya bersifat basofil (suka akan basa). Zat-zat warna yang digunakan untuk pewarnaan sederhana umumnya bersifat alkalin (komponen kromofornya bersifat positif). Pewarnaan sederhana ini memungkinkan dibedakannya bakteri dengan bermacam-macam tipe morfologi (coccus, vibrio, basillus, dsb) dari bahan-bahan lainnya yang ada pasa olesan yang diwarnai (Hadiotomo, 1990).
Pewarnaan negatif, metode ini bukan untuk mewarnai bakteri tetapi mewarnai latar belakangnya menjadi hitam gelap. Pada pewarnaan ini mikroorganisme kelihatan transparan (tembus pandang). Teknik ini berguna untuk menentukan morfologi dan ukuran sel. Pada pewarnaan ini olesan tidak mengalami pemanasan atau perlakuan yang keras dengan bahan-bahan kimia, maka terjadinya penyusutan dan salah satu bentuk agar kurang sehingga penentuan sel dapat diperoleh dengan lebih tepat. Metode ini menggunakan cat nigrosin atau tinta cina (Hadiotomo, 1990).
Struktur di dalam sel pada tempat-tempat yang khas dibentuk oleh spesies ini disebut endospora. Endospora dapat bertahan hidup dalam keadaan kekurangan nutrien, tahan terhadap panas, kekeringan, radiasi UV serta bahan-bahan kimia. Ketahanan tersebut disebabkan oleh adanya selubung spora yang tebal dan keras. Sifat-sifat ini menyebabkan dibutuhkannya perlakuan yang keras untuk mewarnainya. Hanya bila diperlukan panas yang cukup, pewarna yang sesuai dapat menembus endospora. Tetapi sekali pewarna memasuki endospora, sukar untuk dihilangkan. Ukuran dan letak endospora di dalam sel merupakan ciri-ciri yang digunakan untuk membedakan spesies-spesies bakteri yang Membentuknya (Dwidjoseputro, 1989).
Ciri-ciri bakteri gram negatif yaitu (Hadiotomo, 1990) :
- Struktur dinding selnya tipis, sekitar 10 – 15 mm, berlapis tiga atau multilayer.
- Dinding selnya mengandung lemak lebih banyak (11-22%), peptidoglikan terdapat didalam lapisan kaku, sebelah dalam dengan jumlah sedikit 10% dari berat kering, tidak mengandung asam tekoat.
- Kurang rentan terhadap senyawa penisilin.
- Pertumbuhannya tidak begitu dihambat oleh zat warna dasar misalnya kristal violet.
- Komposisi nutrisi yang dibutuhkan relatif sederhana.
- Tidak resisten terhadap gangguan fisik.
Ciri-ciri bakteri gram positif yaitu (Hadiotomo, 1990) :
- Struktur dinding selnya tebal, sekitar 15-80 nm, berlapis tunggal atau monolayer.
- Dinding selnya mengandung lipid yang lebih normal (1-4%), peptidoglikan ada yang sebagai lapisan tunggal. Komponen utama merupakan lebih dari 50% berat ringan. Mengandung asam tekoat.
- Bersifat lebih rentan terhadap penisilin.
- Pertumbuhan dihambat secara nyata oleh zat-zat warna seperti ungu kristal.
- Komposisi nutrisi yang dibutuhkan lebih rumit.
- Lebih resisten terhadap gangguan fisik.
Pengecatan gram dilakukan dalam 4 tahap yaitu (Volk & Wesley, 1998):
1. Pemberian cat warna utama (cairan kristal violet) berwarna ungu.
2. Pengintesifan cat utama dengan penambahan larutan mordan JKJ.
3. Pencucian (dekolarisasi) dengan larutan alkohol asam.
4. Pemberian cat lawan yaitu cat warna safranin
BAB III
METODOLOGI
III. 1 Alat
Alat yang digunakan pada percobaan ini adalah mikroskop, objek gelas, ose bulat, gegep kayu,lampu spritus , korek api,pipet tetes,wadah baskom, botol semprot , dan hand sprayer
III.2 Bahan
Bahan yang digunakan pada percobaan ini adalah Aquadest steri, lBiakan Eschericia coli, Biakan Bacillus cereus, Biakan Salmonella typii, Gram A (Kristal violet), Gram B (larutan lugol), Gram C (Alkohol asam), Gram D (Safranin), Minyak imersi, Tissue roll, Alcohol 70 %, Spirtus, Larutan nigrosin (tinta cina).
III.3 Prosedur Kerja
A. Pengecatan Sederhana
1. Membuat preparat olesan bakteri Bacillus cereus dan Salmonella typii lalu fiksasi dengan pembakar spirtus.
2. Meneteskan larutan Kristal violet diatas olesan preparat tersebut sebanyak 1-2 tetes dan membiarakan selama 1-2 menit.
3. Mencuci dengan air mengalir sampai sisa cat tercuci habis, kemudian mengeringkan dengan hati-hati mengunakan tissue roll.
4. Mengamati dibawah mikroskop dengan menggunakan pembesaran 100x dan minyak imersi.
5. Menggambar dan mencatat hasil yang diamati.
B. Pengecatan Negatif
1. Membersihkan gelas objek dengan alcohol 70 % agar bebas lemak.
2. Mengambil 1 ose yang digunakan umntuk mengambil biakan, meletakkan biakan pada objek gelas kemudian mencampur dengan 1-2 tetes nigrosin.
3. Dengan menggunakan objek gelas lain menyentuhkan sisi objek gelas tersebut pada sampel tersebut sehingga membentuk sudut 300C, selanjutnya menarik objek gelas tersebut dengan arah yang berlawanan hingga membentuk film tipis.
4. Membiarkan hingga mengering lalu mengamati diubawah mikroskop dengan pembesaran 100x dan menggunakan minyak imersi.
5. Menggambar dan mencatat hasil pengamatan.
C. Pengecatan Gram
1. Menyiapkan preparat olesan bakteri Bacillus cereus, Eshcericia coli dan Salmonella typii lalu fiksasi pada pembakar spirtus.
2. Meneteskan larutan gram A sebanyak 2-3 tetes pada olesan bakteri, membiarkan selama 1 menit.
3. Mencuci dengan air mengalir dan mengeringkan dengan tissue roll dengan hati-hati.
4. Meneteskan larutan gram B, membiarkan selama 1 menit.
5. Mencuvi dengan air dan keringkan.
6. Meneteskan larutan gram C, membiarkan selama 30 detik.
7. Mencuci dengan air dan keringkan.
8. Menetesi dengan larutan gram D, membiarkan selama 30 detik, mencuci dengan air dan mengeringkan dengan tissue.
9. Mengamati dibawah mikroskop dengan pembesaran 100x dan menggunakan minyak imersi
BAB IV
HASIL DAN PEMBAHASAN
IV.1 Hasil
IV.2 Pembahasan
A. Pengecatan Sederhana
Pengecatan sederhana digunakan untuk memperlihatkan atau memperjelas kontras antara sel dan latar belakangnya sehingga dapat mempertajam bentuk dari sel-sel mikroba itu sendiri, dengan cara mewarnai sel-sel mikroba dengan zat warna khususnya warna Kristal violet. Pada pengecatan sederhana digunakan bakteri Bacillus cereus dan Salmonella typii. Setelah pengecatan diperoleh bakteri tersebut berwarna ungu, yang berarti bakteri tersebut menyerap zat warna cat tersebut sehingga Nampak pada mikroskop. Zat warna yang umunya digunakan yakni yang bersifat alkalin (kromatofornya bermuatan +).
B. Pengecatan Negatif
Pada pengecatan ini digunakan cat asam nirosin (tinta cina). Pengecatan ini dilakukan untuk mewarnai latar belakang preparat sedangkan bakteri sendiri tidak terwarnai serta untuk mengamati ukuran, bentuk, dan tata letak sel. Setelah pengamatan dibawah mikroskop diperoleh preparat mikroba berwarna hitam sedangkan bakteri sendiri tidak berwarna (berwarna putih) dan berbentuk basil (batang).
C. Pengecatan Gram
Pengecatan gram termasuk pengecatan diferensial yang digunakan untuk membedakan bakteri gram negative dan bakteri gram positif. Pada pengecatn ini digunakan 3 jenis bakteri yaitu Bacillus cereus, Salmonella typii dan Eshericia coli.. Pengecatan ini menggunakan 4 jenis larutan yaitu Kristal violet sebagai cat utama, larutan iodine sebagai pengintensifan cat utama, alcohol asam untuk pencucian dan safranin sebagai cat penutup. Berdasarkan percobaan diperoleh Bacillus cereus dan Salmonella typii bersifat gram positif yang berarti bakteri dapat mengikat dengan kuat cat utama cristal violet berwarna ungu, pada saat bakteri Gram positif ditambahkan dengan kristal violet maka gram positif akan mengabsorbsi larutan tersebut hanya pada dinding sel, dengan pemberian larutan lugol maka kristal violet akan masuk sampai ke inti sel, pemberian alkohol menyebabkan pori-pori dinding sel mengecil sehingga warna ungu tertahan di dalam sel disebabkan oleh rendahnya kandungan lipid. Sedangkan bakteri Eschericia coli bersifat gram negative karena tidak dapat mengikat kuat cat utama dan dapat diwarnai oleh cat lawan yakni merah dari pewarna safranin.
Perbedaan gram (+) dan gram (-)
Sifat Gram (+) Gram (-)
• Komposisi Kandungan lipid rendah Kandungan lipid tinggi
• Ketahanan terhadap penisilin Lebih sensitif Lebih tahan
• Penghambatan warna Lebih dihambat Kurang dihambat
• Ketahanan terhadap fisik Lebih tahan Kurang tahan
• Kebutuhan Nutrien Kompleks Relatif
BAB V
PENUTUP
V.1 Kesimpulan
Berdasarkan percobaan yang dilakukan maka dapat disimpulkan bahwa :
- Pewarnaan mikroorganisme dapat dilakukan dengan cara yaitu dengan pengecatan gram, pengecatan sederhana dan pengecatan negative.
- Pewarnaan sederhana digunakan untuk melihat bentuk dan struktur sel bakteri dengan menggunakan satu jenis pewarna seperti safranin atau kristal violet, pewarnaan gram digunakan untuk membedakan antara bakteri gram (+) dan gram (-) dengan lebih dari satu zat warna sedangkan pewarnaan negative berguna untuk mewarnai latar belakang preparat dan bakteri sendiri tidak terwarnai.
- Bakteri gram negatif pada teknik pewarnaan akan menghasilkan warna merah dan bakteri gram positif akan menghasilkan warna ungu.
V.2 Saran
Saran untuk laboratorium agar percobaan berikutnya keanekaragaman bakteri yang digunakan dapat bertambah lagi sehingga hasil yang diperoleh dapat bervariasi.
DAFTAR PUSTAKA
Dwidjoseputro, D., 1989. Dasar-Dasar Mikrobiologi. Malang : Djambatan.
Hadiotomo, Ratna Siri., 1990. Mikrobiologi Dasar Dalam Praktek. Jakarta : Pt Gramedia.
Jimmo., 2008, http ://Pembuatan PReParAT dan PengeCaTAnnyA _ BLoG KiTa.mht,. diakses pada tanggal 14 April 2009, Makassar.
Fauziah., 2008, www.fkugm2008.com/wp-content/uploads/HSC/1- 2x/6/Praktikum6.pdf. diakses pada tangan 04 April 2009, Makassar.
Filzahazny., 2008, , http:/wordpress.com/Penganta-tentang-bakteri.htm.di akses pada tanggal 08 maret 2009, Makassar.
Rizki., 2008, http ://ngecat bakterimakul-rizki.blogspot.com/2008/02/materi- kuliah.html. diakses pada tanggal 04 April 2009, Makassar.
Volk, Wesley A dan Margareth F. Wheeler., 1998. Mikrobiologi Dasar Jilid I. Jakarta : Erlangga.
Yulneriwanti., 2008, http://01-bakteri.html. diakses pada tanggal 08 Maret 2009. Makassar.
Read More..
Minggu, 17 April 2011
Sintesis Hemoglobin
Sintesis Hemoglobin Sintesis heme terutama terjadi di mitokondria melalui serangkaian reaksi biokomia yang bermula dengan kondensasi glisin dan suksinil koenzim A oleh kerja enzim kunci yang bersifat membatasi kecepatan reaksi yaitu δ-aminolevulinat (ALA) sintase. Piridoksal fosfat (B6) adalah suatu koenzim untuk reaksi ini, yang dirangsang oleh eritropoetin. Akhirnya, protoporfirin bergabung dengan besi dalam bentuk ferro (Fe2+) untuk membentuk heme.
Masing –masing molekul heme bergabung dengan satu rantai globin yang dibuat pada poliribosom. Semua gen globin mempunyai tiga ekson (regio pengkode) dan dua intron (regio yang tidak mengkode, yang DNA-nya tidak terwakili pada protein yang sudah jadi). RNA awal ditranskripsi dari ekson dan intron, dan dari hasil transkripsi ini RNA yang berasal dari intron dibuang melalui suatu proses yang disebut splicing. Intron selalu dimulai dengan suatu dinukleotida G-T dan berakhir dengan dinukleotida A-G. Mesin splicing mengenali urutan tersebut dan juga sekuens dinukleotida didekatnya yang dipertahankan. RNA dalam nukleotida juga ditutupi dengan penambahan suatu struktur pada ujung 5’ yang mengandung gugus tujuh metil-guanosin. Struktur ini mungkin penting untuk perlekatan mRNA pada ribosom. mRNA yang terbentuk tersebut juga mengalami poliadenilasi pada ujung 3’. Poliadenilasi ini menstabilkan mRNA tersebut. Thalasemia dapat terjadi akibat mutasi atau delesi salah satu sekuens tersebut. Sejumlah sekuens lain yang dipertahankan penting dalam sintesis globin, dan mutasi ditempat tersebut dapat menyebabkan thalasemia. Sekuens ini mempengaruhi transkripsi gen, mamastikan kebenarannya dan menetapkan tempat untuk untuk mengawali dan mengakhiri translasi dan memastikan stabilitas mRNA yang disintesis. Promotor ditemukan pada posisi 5’ pada gen, dekat dengan lokasi inisiasi atau lebih distal. Promotor ini adalah lokasi tempat RNA polimerase berikatan dan mengkatalis transkripsi gen. Penguat (enhancer) ditemukan pada posisi 5’ atau 3’ terhadap gen. Penguat penting dalam regulasi ekspresi gen globin yang spesifik, dan dalam regulasi sintesis berbagai rantai globin selama kehidupan janin dan setelah lahir. Regio pengatur lokus (locus control region, LCR) adalah unsur pengatur genetik yang terletak jauh di huli kelompok globin-β yang mengatur aktivitas genetik tiap domain, kemungkinan dengan cara berinteraksi secara fisik dengan regio promotor dan menguraikan kromatin agar faktor transkripsi dapat berikatan. Kelompok gen globin α juga mengandung regio yang mirip dengan LCR, disebut HS40. Faktor transkripsi GATA-1, FoG, dan NF-E2 yang diekspresikan terutama pada prekursor eritroid, penting untuk menentukan ekspresi gen globin dalam sel eritroid. mRNA globin memasuki sitoplasma dan melekat pada ribosom (translasi) tempat terjadinya sintesis rantai globin. Proses ini terjadi melalui perlekatan RNA transfer, masing-masing dengan asam aminonya sendiri, melalui berpasangan nya basa kodon/ antikodon pada posisi yang sesuai dengan cetakan mRNA. Suatu tetramer yang terdiri dari empat rantai globin masing-masing dengan gugus hemenya sendiri dalam suatu ‘kantung’ kemudian dibentuk untuk menyusun satu molekul hemoglobin. Read More..
Masing –masing molekul heme bergabung dengan satu rantai globin yang dibuat pada poliribosom. Semua gen globin mempunyai tiga ekson (regio pengkode) dan dua intron (regio yang tidak mengkode, yang DNA-nya tidak terwakili pada protein yang sudah jadi). RNA awal ditranskripsi dari ekson dan intron, dan dari hasil transkripsi ini RNA yang berasal dari intron dibuang melalui suatu proses yang disebut splicing. Intron selalu dimulai dengan suatu dinukleotida G-T dan berakhir dengan dinukleotida A-G. Mesin splicing mengenali urutan tersebut dan juga sekuens dinukleotida didekatnya yang dipertahankan. RNA dalam nukleotida juga ditutupi dengan penambahan suatu struktur pada ujung 5’ yang mengandung gugus tujuh metil-guanosin. Struktur ini mungkin penting untuk perlekatan mRNA pada ribosom. mRNA yang terbentuk tersebut juga mengalami poliadenilasi pada ujung 3’. Poliadenilasi ini menstabilkan mRNA tersebut. Thalasemia dapat terjadi akibat mutasi atau delesi salah satu sekuens tersebut. Sejumlah sekuens lain yang dipertahankan penting dalam sintesis globin, dan mutasi ditempat tersebut dapat menyebabkan thalasemia. Sekuens ini mempengaruhi transkripsi gen, mamastikan kebenarannya dan menetapkan tempat untuk untuk mengawali dan mengakhiri translasi dan memastikan stabilitas mRNA yang disintesis. Promotor ditemukan pada posisi 5’ pada gen, dekat dengan lokasi inisiasi atau lebih distal. Promotor ini adalah lokasi tempat RNA polimerase berikatan dan mengkatalis transkripsi gen. Penguat (enhancer) ditemukan pada posisi 5’ atau 3’ terhadap gen. Penguat penting dalam regulasi ekspresi gen globin yang spesifik, dan dalam regulasi sintesis berbagai rantai globin selama kehidupan janin dan setelah lahir. Regio pengatur lokus (locus control region, LCR) adalah unsur pengatur genetik yang terletak jauh di huli kelompok globin-β yang mengatur aktivitas genetik tiap domain, kemungkinan dengan cara berinteraksi secara fisik dengan regio promotor dan menguraikan kromatin agar faktor transkripsi dapat berikatan. Kelompok gen globin α juga mengandung regio yang mirip dengan LCR, disebut HS40. Faktor transkripsi GATA-1, FoG, dan NF-E2 yang diekspresikan terutama pada prekursor eritroid, penting untuk menentukan ekspresi gen globin dalam sel eritroid. mRNA globin memasuki sitoplasma dan melekat pada ribosom (translasi) tempat terjadinya sintesis rantai globin. Proses ini terjadi melalui perlekatan RNA transfer, masing-masing dengan asam aminonya sendiri, melalui berpasangan nya basa kodon/ antikodon pada posisi yang sesuai dengan cetakan mRNA. Suatu tetramer yang terdiri dari empat rantai globin masing-masing dengan gugus hemenya sendiri dalam suatu ‘kantung’ kemudian dibentuk untuk menyusun satu molekul hemoglobin. Read More..
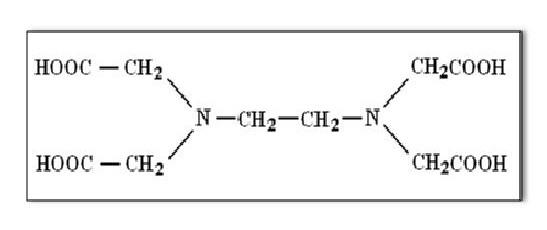
Rumus Bangun EDTA
EDTA adalah kependekan dari ethylene diamin tetra acetic. EDTA berupa senyawa kompleks khelat dengan rumus molekul (HO2CCH2)2NCH2CH2N(CH2CO2H)2. Merupakan suatu senyawa asam amino yang secara luas dipergunakan untuk mengikat ion logam logam bervalensi dua dan tiga. EDTA mengikat logam melalui empat karboksilat dan dua gugus amina. EDTA membentuk kompleks kuat terutama dengan Mn (II), Cu (II), Fe (III), dan Co (III) (Anonim, 2008).
Etilendiamintetrasetat atau yang dikenal dengan EDTA, merupakan senyawa yang mudah larut dalam air, serta dapat diperoleh dalam keadaan murni. Tetapi dalam penggunaannya, karena adanya sejumlah tidak tertentu dalam air, sebaiknya distandardisasi terlebih dahulu.
Etilendiamintetrasetat atau yang dikenal dengan EDTA, merupakan senyawa yang mudah larut dalam air, serta dapat diperoleh dalam keadaan murni. Tetapi dalam penggunaannya, karena adanya sejumlah tidak tertentu dalam air, sebaiknya distandardisasi terlebih dahulu.
Gambar 2.1 Struktur EDTA
Terlihat dari strukturnya bahwa molekul tersebut mengandung baik donor elektron dari atom oksigen maupun donor dari atom nitrogen sehingga dapat menghasilkan khelat bercincin sampai dengan enam secara serempak
Read More..
Kamis, 07 April 2011
Penetapan Kadar Hemoglobin
 Hemoglobin merupakan protein yang terdapat dalam sel darah merah atau eritrosit, yang memberi warna merah pada darah. Hemoglobin terdiri atas zat besi yang merupakan pembawa oksigen. Kadar hemoglobin dapat ditetapkan dengan berbagai cara, antara lain metode Sahli, oksihemoglobin atau sianmethhemoglobin.
Hemoglobin merupakan protein yang terdapat dalam sel darah merah atau eritrosit, yang memberi warna merah pada darah. Hemoglobin terdiri atas zat besi yang merupakan pembawa oksigen. Kadar hemoglobin dapat ditetapkan dengan berbagai cara, antara lain metode Sahli, oksihemoglobin atau sianmethhemoglobin.Metode Sahli tidak dianjurkan karena memiliki kesalahan yang besar, alatnya tidak dapat distandardisasi, dan tidak semua jenis hemoglobin dapat diukur, seperti sulfhemoglobin, methemoglobin dan karboksihemoglobin. Dua metode yang lain (oksihemoglobin dan sianmethemoglobin) dapat diterima dalam hemoglobinometri klinik. Namun, dari dua metode tersebut, metode sianmethemoglobin adalah metode yang dianjurkan oleh International Commitee for Standardization in Hematology (ICSH) sebab selain mudah dilakukan juga mempunyai standar yang stabil dan hampir semua hemoglobin dapat terukur, kecuali sulfhemoglobin.
Dasar Penetapan
Penetapan Hb metode Sahli didasarkan atas pembentukan hematin asam setelah darah ditambah dengan larutan HCl 0.1N kemudian diencerkan dengan aquadest. Pengukuran secara visual dengan mencocokkan warna larutan sampel dengan warna batang gelas standar. Metode ini memiliki kesalahan sebesar 10-15%, sehingga tidak dapat untuk menghitung indeks eritrosit.
Penetapan kadar Hb metode oksihemoglobin didasarkan atas pembentukan oksihemoglobin setelah sampel darah ditambah larutan Natrium karbonat 0.1% atau Ammonium hidroksida. Kadar Hb ditentukan dengan mengukur intensitas warna yang terbentuk secara spektrofotometri pada panjang gelombang 540 nm. Metode ini tidak dipengaruhi oleh kadar bilirubin tetapi standar oksihemoglobin tidak stabil.
Metode sianmethemoglin didasarkan pada pembentukan sianmethemoglobin yang intensitas warnanya diukur secara fotometri. Reagen yang digunakan adalah larutan Drabkin yang mengandung Kalium ferisianida (K3Fe[CN]6) dan kalium sianida (KCN). Ferisianida mengubah besi pada hemoglobin dari bentuk ferro ke bentuk ferri menjadi methemoglobin yang kemudian bereaksi dengan KCN membentuk pigmen yang stabil yaitu sianmethemoglobin. Intensitas warna yang terbentuk diukur secara fotometri pada panjang gelombang 540 nm.
Selain K3Fe[CN]6 dan KCN, larutan Drabkin juga mengandung kalium dihidrogen fosfat (KH2PO4) dan deterjen. Kalium dihidrogen fosfat berfungsi menstabilkan pH dimana rekasi dapat berlangsung sempurna pada saat yang tepat. Deterjen berfungsi mempercepat hemolisis darah serta mencegah kekeruhan yang terjadi oleh protein plasma.
Bahan Pemeriksaan
Bahan pemeriksaan yang digunakan untuk penetapan kadar hemoglobin (Hb) adalah darah kapiler atau darah EDTA.
Prosedur
Prosedur pemeriksaan yang akan dibicarakan di sini adalah prosedur yang menggunakan metode sianmethemoglobin. Ke dalam tabung reaksi dimasukkan 5 ml larutan Drabkin lalu ditambah 20 ul sampel darah. Lakukan pencampuran dengan cara membolak-balikkan tabung beberapa kali. Diamkan pada suhu kamar selama 3-5 menit kemudian ukur intensitas warna dengan fotometer pada panjang gelombang 540 nm dengan blanko reagen.
Kadar Hb dapat dibaca pada kurve kalibrasi atau dihitung dengan menggunakan faktor, dimana kadar Hb = serapan x faktor. Kurve kalibrasi dan faktor telah dipersiapkan sebelumnya.
Membuat Kurva Kalibrasi dan Perhitungan Faktor
Sebelum melakukan penetapan kadar Hb, fotometer harus dikalibrasi dulu atau dihitung faktornya. Untuk keperluan tersebut disiapkan larutan standar Hemisianida (sianmethemoglobin) dan pengenceran larutan tersebut dalam larutan Drabkin. Kadar Hb dari larutan standar dapat dihitung dengan rumus = kadar hemisianida x 0.251 g/dl
Buatlah pengenceran larutan standar 100, 75, 50, 25 dan 0 %, sebagai blanko dengan larutan Drabkin. Setelah semua tercampur, biarkan 3-5 menit pada suhu kamar lalu baca serapan (absorbance atau optical density/OD) pada fotometer dengan panjang gelombang 540 nm. Buatlah kurvenya dengan kadar Hb sebagai absis dan serapan sebagai ordinat. Selanjutnya untuk menetapkan kadar Hb pasien tinggal memplotkan pada kurve kalibrasi.
Jika memilih menggunakan perhitungan faktor, maka jumlahkan dulu nilai serapan (= total OD) dan kadar Hb larutan standar (= total kadar) yang telah diencerkan 100, 75, 50, 25 dan 0 %. Faktor (F) = total OD : total kadar
Kadar Hb pasien = OD pasien x F
Fotometer saat ini telah banyak yang dirancang untuk dapat menghitung secara otomatis dimana kadar Hb yang diukur sudah langsung diketahui tanpa kita harus melakukan penghitungan secara manual.
Nilai Rujukan
Dewasa pria : 13.2 - 17.3 g/dl
Perempuan : 11.7 - 15.5 g/dl
Bayi baru lahir : 15.2 - 23.6 g/dl
Anak usia 1-3 tahun : 10.8 - 12.8 g/dl
Anak usia 4-5 tahun : 10.7 - 14.7 g/dl
Anak usia 6-10 tahun : 10.8 - 15.6 g/dl
Masalah Klinis
- Penurunan kadar : anemia (defisiensi besi, aplastik, hemolitik, dsb), perdarahan hebat, leukemia, kanker (usus besar, usus halus, rektum, hati, tulang, dsb), thalasemia, penyakit ginjal, penyakit Hodgkin, kehamilan, sarkoidosis, kelebihan cairan intra-vena. Pengaruh obat : antibiotik (kloramfenikol [chloromycetin], penisilin, tetrasiklin), aspirin, antineoplastik, doksapram (dopram), derivat hidantoin, vitamin A dosis besar, hidralazin (Apresoline), indometasin (Indocin), inhibitor MAO, primakuin, rifampin, sulfonamid, trimetadion (Tridione)
- Peningkatan kadar : dehidrasi/hemokonsentrasi, polisitemia, daerah dataran tinggi, chronic heart failure (CHF), luka bakar yang parah. Pengaruh obat : gentamisin, metildopa (Aldomet)
Faktor Yang Mempengaruhi Temuan Laboratorium
- Pengaruh obat (lihat keterangan di atas)
- Mengambil darah pada tangan atau lengan yang terpasang cairan intra-vena menyebabkan darah terencerkan
- Memasang turniket terlalu lama (lebih dari 1 menit) menyebabkan hemokonsentrasi
- Tinggal di dataran tinggi menyebabkan peningkatan kadar Hb
- Penurunan asupan atau kehilangan cairan akan meningkatkan kadar Hb akibat hemokonsentrasi, dan kelebihan asupan cairan akan mengurangi kadar Hb akibat hemodilusi
Pengumpulan Sampel Darah
Dalam kegiatan pengumpulan sampel darah dikenal istilah phlebotomy yang berarti proses mengeluarkan darah. Dalam praktek laboratorium klinik, ada 3 macam cara memperoleh darah, yaitu : melalui tusukan vena (venipuncture), tusukan kulit (skinpuncture) dan tusukan arteri atau nadi. Venipuncture adalah cara yang paling umum dilakukan, oleh karena itu istilah phlebotomy sering dikaitkan dengan venipuncture.
PENGAMBILAN DARAH VENA
 Pada pengambilan darah vena (venipuncture), contoh darah umumnya diambil dari vena median cubital, pada anterior lengan (sisi dalam lipatan siku). Vena ini terletak dekat dengan permukaan kulit, cukup besar, dan tidak ada pasokan saraf besar. Apabila tidak memungkinkan, vena chepalica atau vena basilica bisa menjadi pilihan berikutnya. Venipuncture pada vena basilica harus dilakukan dengan hati-hati karena letaknya berdekatan dengan arteri brachialis dan syaraf median.
Pada pengambilan darah vena (venipuncture), contoh darah umumnya diambil dari vena median cubital, pada anterior lengan (sisi dalam lipatan siku). Vena ini terletak dekat dengan permukaan kulit, cukup besar, dan tidak ada pasokan saraf besar. Apabila tidak memungkinkan, vena chepalica atau vena basilica bisa menjadi pilihan berikutnya. Venipuncture pada vena basilica harus dilakukan dengan hati-hati karena letaknya berdekatan dengan arteri brachialis dan syaraf median.
Jika vena cephalica dan basilica ternyata tidak bisa digunakan, maka pengambilan darah dapat dilakukan di vena di daerah pergelangan tangan. Lakukan pengambilan dengan dengan sangat hati-hati dan menggunakan jarum yang ukurannya lebih kecil.
Lokasi yang tidak diperbolehkan diambil darah adalah :
Beberapa hal penting yang harus diperhatikan dalam pengambilan darah vena adalah :
Pengambilan Darah Vena dengan Syring
Pengambilan darah vena secara manual dengan alat suntik (syring) merupakan cara yang masih lazim dilakukan di berbagai laboratorium klinik dan tempat-tempat pelayanan kesehatan. Alat suntik ini adalah sebuah pompa piston sederhana yang terdiri dari sebuah sebuah tabung silinder, pendorong, dan jarum. Berbagai ukuran jarum yang sering dipergunakan mulai dari ukuran terbesar sampai dengan terkecil adalah : 21G, 22G, 23G, 24G dan 25G.
Pengambilan darah dengan suntikan ini baik dilakukan pada pasien usia lanjut dan pasien dengan vena yang tidak dapat diandalkan (rapuh atau kecil).
Prosedur :
Pengambilan Darah Vena Dengan Tabung Vakum
Tabung vakum pertama kali dipasarkan oleh perusahaan AS BD (Becton-Dickinson) di bawah nama dagang Vacutainer. Jenis tabung ini berupa tabung reaksi yang hampa udara, terbuat dari kaca atau plastik. Ketika tabung dilekatkan pada jarum, darah akan mengalir masuk ke dalam tabung dan berhenti mengalir ketika sejumlah volume tertentu telah tercapai.
 Jarum yang digunakan terdiri dari dua buah jarum yang dihubungkan oleh sambungan berulir. Jarum pada sisi anterior digunakan untuk menusuk vena dan jarum pada sisi posterior ditancapkan pada tabung. Jarum posterior diselubungi oleh bahan dari karet sehingga dapat mencegah darah dari pasien mengalir keluar. Sambungan berulir berfungsi untuk melekatkan jarum pada sebuah holder dan memudahkan pada saat mendorong tabung menancap pada jarum posterior.
Jarum yang digunakan terdiri dari dua buah jarum yang dihubungkan oleh sambungan berulir. Jarum pada sisi anterior digunakan untuk menusuk vena dan jarum pada sisi posterior ditancapkan pada tabung. Jarum posterior diselubungi oleh bahan dari karet sehingga dapat mencegah darah dari pasien mengalir keluar. Sambungan berulir berfungsi untuk melekatkan jarum pada sebuah holder dan memudahkan pada saat mendorong tabung menancap pada jarum posterior.
Keuntungan menggunakan metode pengambilan ini adalah, tak perlu membagi-bagi sampel darah ke dalam beberapa tabung. Cukup sekali penusukan, dapat digunakan untuk beberapa tabung secara bergantian sesuai dengan jenis tes yang diperlukan. Untuk keperluan tes biakan kuman, cara ini juga lebih bagus karena darah pasien langsung dapat mengalir masuk ke dalam tabung yang berisi media biakan kuman. Jadi, kemungkinan kontaminasi selama pemindahan sampel pada pengambilan dengan cara manual dapat dihindari.
Kekurangannya sulitnya pengambilan pada orang tua, anak kecil, bayi, atau jika vena tidak bisa diandalkan (kecil, rapuh), atau jika pasien gemuk. Untuk mengatasi hal ini mungkin bisa digunakan jarum bersayap (winged needle).
 Jarum bersayap atau sering juga dinamakan jarum “kupu-kupu” hampir sama dengan jarum vakutainer seperti yang disebutkan di atas. Perbedaannya adalah, antara jarum anterior dan posterior terdapat dua buah sayap plastik pada pangkal jarum anterior dan selang yang menghubungkan jarum anterior dan posterior. Jika penusukan tepat mengenai vena, darah akan kelihatan masuk pada selang (flash).
Jarum bersayap atau sering juga dinamakan jarum “kupu-kupu” hampir sama dengan jarum vakutainer seperti yang disebutkan di atas. Perbedaannya adalah, antara jarum anterior dan posterior terdapat dua buah sayap plastik pada pangkal jarum anterior dan selang yang menghubungkan jarum anterior dan posterior. Jika penusukan tepat mengenai vena, darah akan kelihatan masuk pada selang (flash).
Prosedur :
Menampung Darah Dalam Tabung
Beberapa jenis tabung sampel darah yang digunakan dalam praktek laboratorium klinik adalah sebagai berikut :
PENGAMBILAN DARAH KAPILER
Pengambilan darah kapiler atau dikenal dengan istilah skinpuncture yang berarti proses pengambilan sampel darah dengan tusukan kulit. Tempat yang digunakan untuk pengambilan darah kapiler adalah :
Prosedur
Pengambilan Darah Arteri
Pengambilan darah arteri umumnya menggunakan arteri radialis di daerah pergelangan tangan. Jika tidak memungkinkan dapat dipilih arteri brachialis di daerah lengan atau arteri femoralis di lipat paha. Pengambilan darah harus dilakukan dengan hati-hati dan oleh tenaga terlatih.
Sampel darah arteri umumnya digunakan untuk pemeriksaan analisa gas darah.
Prosedur
PENGAMBILAN DARAH VENA
 Pada pengambilan darah vena (venipuncture), contoh darah umumnya diambil dari vena median cubital, pada anterior lengan (sisi dalam lipatan siku). Vena ini terletak dekat dengan permukaan kulit, cukup besar, dan tidak ada pasokan saraf besar. Apabila tidak memungkinkan, vena chepalica atau vena basilica bisa menjadi pilihan berikutnya. Venipuncture pada vena basilica harus dilakukan dengan hati-hati karena letaknya berdekatan dengan arteri brachialis dan syaraf median.
Pada pengambilan darah vena (venipuncture), contoh darah umumnya diambil dari vena median cubital, pada anterior lengan (sisi dalam lipatan siku). Vena ini terletak dekat dengan permukaan kulit, cukup besar, dan tidak ada pasokan saraf besar. Apabila tidak memungkinkan, vena chepalica atau vena basilica bisa menjadi pilihan berikutnya. Venipuncture pada vena basilica harus dilakukan dengan hati-hati karena letaknya berdekatan dengan arteri brachialis dan syaraf median.Jika vena cephalica dan basilica ternyata tidak bisa digunakan, maka pengambilan darah dapat dilakukan di vena di daerah pergelangan tangan. Lakukan pengambilan dengan dengan sangat hati-hati dan menggunakan jarum yang ukurannya lebih kecil.
Lokasi yang tidak diperbolehkan diambil darah adalah :
- Lengan pada sisi mastectomy
- Daerah edema
- Hematoma
- Daerah dimana darah sedang ditransfusikan
- Daerah bekas luka
- Daerah dengan cannula, fistula atau cangkokan vascular
- Daerah intra-vena lines Pengambilan darah di daerah ini dapat menyebabkan darah menjadi lebih encer dan dapat meningkatkan atau menurunkan kadar zat tertentu.
Beberapa hal penting yang harus diperhatikan dalam pengambilan darah vena adalah :
- Pemasangan turniket (tali pembendung)
- pemasangan dalam waktu lama dan terlalu keras dapat menyebabkan hemokonsentrasi (peningkatan nilai hematokrit/PCV dan elemen sel), peningkatan kadar substrat (protein total, AST, besi, kolesterol, lipid total)
- melepas turniket sesudah jarum dilepas dapat menyebabkan hematoma
- Jarum dilepaskan sebelum tabung vakum terisi penuh sehingga mengakibatkan masukknya udara ke dalam tabung dan merusak sel darah merah.
- Penusukan
- penusukan yang tidak sekali kena menyebabkan masuknya cairan jaringan sehingga dapat mengaktifkan pembekuan. Di samping itu, penusukan yang berkali-kali juga berpotensi menyebabkan hematoma.
- tutukan jarum yang tidak tepat benar masuk ke dalam vena menyebabkan darah bocor dengan akibat hematoma
- Kulit yang ditusuk masih basah oleh alkohol menyebabkan hemolisis sampel akibat kontaminasi oleh alcohol, rasa terbakar dan rasa nyeri yang berlebihan pada pasien ketika dilakukan penusukan.
Pengambilan Darah Vena dengan Syring
Pengambilan darah vena secara manual dengan alat suntik (syring) merupakan cara yang masih lazim dilakukan di berbagai laboratorium klinik dan tempat-tempat pelayanan kesehatan. Alat suntik ini adalah sebuah pompa piston sederhana yang terdiri dari sebuah sebuah tabung silinder, pendorong, dan jarum. Berbagai ukuran jarum yang sering dipergunakan mulai dari ukuran terbesar sampai dengan terkecil adalah : 21G, 22G, 23G, 24G dan 25G.
Pengambilan darah dengan suntikan ini baik dilakukan pada pasien usia lanjut dan pasien dengan vena yang tidak dapat diandalkan (rapuh atau kecil).
Prosedur :
- Persiapkan alat-alat yang diperlukan : syring, kapas alkohol 70%, tali pembendung (turniket), plester, dan tabung. Untuk pemilihan syring, pilihlah ukuran/volume sesuai dengan jumlah sampel yang akan diambil, pilih ukuran jarum yang sesuai, dan pastikan jarum terpasang dengan erat.
- Lakukan pendekatan pasien dengan tenang dan ramah; usahakan pasien senyaman mungkin.
- Identifikasi pasien dengan benar sesuai dengan data di lembar permintaan.
- Verifikasi keadaan pasien, misalnya puasa atau konsumsi obat. Catat bila pasien minum obat tertentu, tidak puasa dsb.
- Minta pasien meluruskan lengannya, pilih lengan yang banyak melakukan aktifitas.
- Minta pasien mengepalkan tangan.
- Pasang tali pembendung (turniket) kira-kira 10 cm di atas lipat siku.
- Pilih bagian vena median cubital atau cephalic. Lakukan perabaan (palpasi) untuk memastikan posisi vena; vena teraba seperti sebuah pipa kecil, elastis dan memiliki dinding tebal. Jika vena tidak teraba, lakukan pengurutan dari arah pergelangan ke siku, atau kompres hangat selama 5 menit daerah lengan.
- Bersihkan kulit pada bagian yang akan diambil dengan kapas alcohol 70% dan biarkan kering. Kulit yang sudah dibersihkan jangan dipegang lagi.
- Tusuk bagian vena dengan posisi lubang jarum menghadap ke atas. Jika jarum telah masuk ke dalam vena, akan terlihat darah masuk ke dalam semprit (dinamakan flash). Usahakan sekali tusuk kena.
- Setelah volume darah dianggap cukup, lepas turniket dan minta pasien membuka kepalan tangannya. Volume darah yang diambil kira-kira 3 kali jumlah serum atau plasma yang diperlukan untuk pemeriksaan.
- Letakkan kapas di tempat suntikan lalu segera lepaskan/tarik jarum. Tekan kapas beberapa sat lalu plester selama kira-kira 15 menit. Jangan menarik jarum sebelum turniket dibuka.
Pengambilan Darah Vena Dengan Tabung Vakum
Tabung vakum pertama kali dipasarkan oleh perusahaan AS BD (Becton-Dickinson) di bawah nama dagang Vacutainer. Jenis tabung ini berupa tabung reaksi yang hampa udara, terbuat dari kaca atau plastik. Ketika tabung dilekatkan pada jarum, darah akan mengalir masuk ke dalam tabung dan berhenti mengalir ketika sejumlah volume tertentu telah tercapai.
 Jarum yang digunakan terdiri dari dua buah jarum yang dihubungkan oleh sambungan berulir. Jarum pada sisi anterior digunakan untuk menusuk vena dan jarum pada sisi posterior ditancapkan pada tabung. Jarum posterior diselubungi oleh bahan dari karet sehingga dapat mencegah darah dari pasien mengalir keluar. Sambungan berulir berfungsi untuk melekatkan jarum pada sebuah holder dan memudahkan pada saat mendorong tabung menancap pada jarum posterior.
Jarum yang digunakan terdiri dari dua buah jarum yang dihubungkan oleh sambungan berulir. Jarum pada sisi anterior digunakan untuk menusuk vena dan jarum pada sisi posterior ditancapkan pada tabung. Jarum posterior diselubungi oleh bahan dari karet sehingga dapat mencegah darah dari pasien mengalir keluar. Sambungan berulir berfungsi untuk melekatkan jarum pada sebuah holder dan memudahkan pada saat mendorong tabung menancap pada jarum posterior.Keuntungan menggunakan metode pengambilan ini adalah, tak perlu membagi-bagi sampel darah ke dalam beberapa tabung. Cukup sekali penusukan, dapat digunakan untuk beberapa tabung secara bergantian sesuai dengan jenis tes yang diperlukan. Untuk keperluan tes biakan kuman, cara ini juga lebih bagus karena darah pasien langsung dapat mengalir masuk ke dalam tabung yang berisi media biakan kuman. Jadi, kemungkinan kontaminasi selama pemindahan sampel pada pengambilan dengan cara manual dapat dihindari.
Kekurangannya sulitnya pengambilan pada orang tua, anak kecil, bayi, atau jika vena tidak bisa diandalkan (kecil, rapuh), atau jika pasien gemuk. Untuk mengatasi hal ini mungkin bisa digunakan jarum bersayap (winged needle).
 Jarum bersayap atau sering juga dinamakan jarum “kupu-kupu” hampir sama dengan jarum vakutainer seperti yang disebutkan di atas. Perbedaannya adalah, antara jarum anterior dan posterior terdapat dua buah sayap plastik pada pangkal jarum anterior dan selang yang menghubungkan jarum anterior dan posterior. Jika penusukan tepat mengenai vena, darah akan kelihatan masuk pada selang (flash).
Jarum bersayap atau sering juga dinamakan jarum “kupu-kupu” hampir sama dengan jarum vakutainer seperti yang disebutkan di atas. Perbedaannya adalah, antara jarum anterior dan posterior terdapat dua buah sayap plastik pada pangkal jarum anterior dan selang yang menghubungkan jarum anterior dan posterior. Jika penusukan tepat mengenai vena, darah akan kelihatan masuk pada selang (flash).Prosedur :
- Persiapkan alat-alat yang diperlukan : jarum, kapas alkohol 70%, tali pembendung (turniket), plester, tabung vakum.
- Pasang jarum pada holder, pastikan terpasang erat.
- Lakukan pendekatan pasien dengan tenang dan ramah; usahakan pasien senyaman mungkin.
- Identifikasi pasien dengan benar sesuai dengan data di lembar permintaan.
- Verifikasi keadaan pasien, misalnya puasa atau konsumsi obat. Catat bila pasien minum obat tertentu, tidak puasa dsb.
- Minta pasien meluruskan lengannya, pilih lengan yang banyak melakukan aktifitas.
- Minta pasien mengepalkan tangan.
- Pasang tali pembendung (turniket) kira-kira 10 cm di atas lipat siku.
- Pilih bagian vena median cubital atau cephalic. Lakukan perabaan (palpasi) untuk memastikan posisi vena; vena teraba seperti sebuah pipa kecil, elastis dan memiliki dinding tebal. Jika vena tidak teraba, lakukan pengurutan dari arah pergelangan ke siku, atau kompres hangat selama 5 menit daerah lengan.
- Bersihkan kulit pada bagian yang akan diambil dengan kapas alcohol 70% dan biarkan kering. Kulit yang sudah dibersihkan jangan dipegang lagi.
- Tusuk bagian vena dengan posisi lubang jarum menghadap ke atas. Masukkan tabung ke dalam holder dan dorong sehingga jarum bagian posterior tertancap pada tabung, maka darah akan mengalir masuk ke dalam tabung. Tunggu sampai darah berhenti mengalir. Jika memerlukan beberapa tabung, setelah tabung pertama terisi, cabut dan ganti dengan tabung kedua, begitu seterusnya.
- Lepas turniket dan minta pasien membuka kepalan tangannya. Volume darah yang diambil kira-kira 3 kali jumlah serum atau plasma yang diperlukan untuk pemeriksaan.
- Letakkan kapas di tempat suntikan lalu segera lepaskan/tarik jarum. Tekan kapas beberapa sat lalu plester selama kira-kira 15 menit. Jangan menarik jarum sebelum turniket dibuka.
Menampung Darah Dalam Tabung
Beberapa jenis tabung sampel darah yang digunakan dalam praktek laboratorium klinik adalah sebagai berikut :
- Tabung tutup merah. Tabung ini tanpa penambahan zat additive, darah akan menjadi beku dan serum dipisahkan dengan pemusingan. Umumnya digunakan untuk pemeriksaan kimia darah, imunologi, serologi dan bank darah (crossmatching test)
- Tabung tutup kuning. Tabung ini berisi gel separator (serum separator tube/SST) yang fungsinya memisahkan serum dan sel darah. Setelah pemusingan, serum akan berada di bagian atas gel dan sel darah berada di bawah gel. Umumnya digunakan untuk pemeriksaan kimia darah, imunologi dan serologi
- Tabung tutup hijau terang. Tabung ini berisi gel separator (plasma separator tube/PST) dengan antikoagulan lithium heparin. Setelah pemusingan, plasma akan berada di bagian atas gel dan sel darah berada di bawah gel. Umumnya digunakan untuk pemeriksaan kimia darah.
- Tabung tutup ungu atau lavender. Tabung ini berisi EDTA. Umumnya digunakan untuk pemeriksaan darah lengkap dan bank darah (crossmatch)
- Tabung tutup biru. Tabung ini berisi natrium sitrat. Umumnya digunakan untuk pemeriksaan koagulasi (mis. PPT, APTT)
- Tabung tutup hijau. Tabung ini berisi natrium atau lithium heparin, umumnya digunakan untuk pemeriksaan fragilitas osmotik eritrosit, kimia darah.
- Tabung tutup biru gelap. Tabung ini berisi EDTA yang bebas logam, umumnya digunakan untuk pemeriksaan trace element (zink, copper, mercury) dan toksikologi.
- Tabung tutup abu-abu terang. Tabung ini berisi natrium fluoride dan kalium oksalat, digunakan untuk pemeriksaan glukosa.
- Tabung tutup hitam ; berisi bufer sodium sitrat, digunakan untuk pemeriksaan LED (ESR).
- Tabung tutup pink ; berisi potassium EDTA, digunakan untuk pemeriksaan imunohematologi.
- Tabung tutup putih ; potassium EDTA, digunakan untuk pemeriksaan molekuler/PCR dan bDNA.
- Tabung tutup kuning dengan warna hitam di bagian atas ; berisi media biakan, digunakan untuk pemeriksaan mikrobiologi - aerob, anaerob dan jamur
- Darah dari syring atau suntikan harus dimasukkan ke dalam tabung dengan cara melepas jarum lalu mengalirkan darah perlahan-lahan melalui dinding tabung. Memasukkan darah dengan cara disemprotkan, apalagi tanpa melepas jarum, berpotensi menyebabkan hemolisis. Memasukkan darah ke dalam tabung vakum dengan cara menusukkan jarum pada tutup tabung, biarkan darah mengalir sampai berhenti sendiri ketika volume telah terpenuhi.
- Homogenisasi sampel jika menggunakan antikoagulan dengan cara memutar-mutar tabung 4-5 kali atau membolak-balikkan tabung 5-10 kali dengan lembut. Mengocok sampel berpotensi menyebabkan hemolisis.
- Urutan memasukkan sampel darah ke dalam tabung vakum adalah : pertama - botol biakan (culture) darah atau tabung tutup kuning-hitam kedua - tes koagulasi (tabung tutup biru), ketiga - tabung non additive (tutup merah), keempat - tabung tutup merah atau kuning dengan gel separator atau clot activator, tabung tutup ungu/lavendet (EDTA), tabung tutup hijau (heparin), tabung tutup abu-abu (NaF dan Na oksalat)
PENGAMBILAN DARAH KAPILER
Pengambilan darah kapiler atau dikenal dengan istilah skinpuncture yang berarti proses pengambilan sampel darah dengan tusukan kulit. Tempat yang digunakan untuk pengambilan darah kapiler adalah :
- Ujung jari tangan (fingerstick) atau anak daun telinga.
- Untuk anak kecil dan bayi diambil di tumit (heelstick) pada 1/3 bagian tepi telapak kaki atau ibu jari kaki.
- Lokasi pengambilan tidak boleh menunjukkan adanya gangguan peredaran, seperti vasokonstriksi (pucat), vasodilatasi (oleh radang, trauma, dsb), kongesti atau sianosis setempat.
Prosedur
- Siapkan peralatan sampling : lancet steril, kapas alcohol 70%.
- Pilih lokasi pengambilan lalu desinfeksi dengan kapas alkohol 70%, biarkan kering.
- Peganglah bagian tersebut supaya tidak bergerak dan tekan sedikit supaya rasa nyeri berkurang.
- Tusuk dengan lancet steril. Tusukan harus dalam sehingga darah tidak harus diperas-peras keluar. Jangan menusukkan lancet jika ujung jari masih basah oleh alkohol. Hal ini bukan saja karena darah akan diencerkan oleh alkohol, tetapi darah juga melebar di atas kulit sehingga susah ditampung dalam wadah.
- Setelah darah keluar, buang tetes darah pertama dengan memakai kapas kering, tetes berikutnya boleh dipakai untuk pemeriksaan.
- Pengambilan darah diusahakan tidak terlalu lama dan jangan diperas-peras untuk mencegah terbentuknya jendalan.
Pengambilan Darah Arteri
Pengambilan darah arteri umumnya menggunakan arteri radialis di daerah pergelangan tangan. Jika tidak memungkinkan dapat dipilih arteri brachialis di daerah lengan atau arteri femoralis di lipat paha. Pengambilan darah harus dilakukan dengan hati-hati dan oleh tenaga terlatih.
Sampel darah arteri umumnya digunakan untuk pemeriksaan analisa gas darah.
Prosedur
- Siapkan peralatan sampling di tempat/ruangan dimana akan dilakukan sampling.
- Pilih bagian arteri radialis.
- Pasang tali pembendung (tourniquet) jika diperlukan.
- Lakukan palpasi (perabaan) dengan jari tangan untuk memastikan letak arteri.
- Desinfeksi kulit yang akan ditusuk dengan kapas alkohol 70%, biarkan kering. Kulit yang telah dibersihkan jangan dipegang lagi.
- Tekan bagian arteri yang akan ditusuk dengan dua jari tangan lalu tusukkan jarum di samping bawah jari telunjuk dengan posisi jarum tegak atau agak miring. Jika tusukan berhasil darah terlihat memasuki spuit dan mendorong thorak ke atas.
- Setelah tercapai volume darah yang dikehendaki, lepaskan/tarik jarum dan segera letakkan kapas pada tempat tusukan lalu tekan kapas kuat-kuat selama ±2 menit. Pasang plester pada bagian ini selama ±15 menit.
Selasa, 05 April 2011
Uya Kuya Merespon Kritik Ulama
JAKARTA (Pos Kota) – Sukses di ajang Panasonic Global Award 2011 kemarin, tak lantas bikin jumawa Uya Kuya. Peraih penghargaan sebagai tayangan dan presenter terfavorit tersebut, mengaku tetap harus merespon sejumlah kritik yang datang. Salah satunya dari Komunitas Ulama se-Jawa dan Madura.
Uya menegaskan tak ada yang sempurna dalam kehidupan ini. Termasuk dalam pembuatan dan penayangan program Uya Memang Kuya. Maka itu, begitu datang kritik kalau program tersebut kental dengan unsur magic dan qhibah, langsung diresponnya.
“Terima kasih adanya kritik tersebut. Sebisa mungkin kami akan memberikan perhatian khusus. Ya, harapannya, tentu saja bisa lebih baik dari sebelumnya. Apalagi, setelah menerima penghargaan dari Panasonic Global Award 2011 kemarin,” ungkap Uya, panjang lebar.
Untuk tidak melanggar rambu-rambu, Uya Kuya siap berdialog dengan pihak siapa saja. “Saya cuma ingin tayangan Uya Memang Kuya bisa jalan terus. Tentu saja dengan manfaat yang lebih positif. Jadi, bukan sekadar menghibur,” tegasnya.
Patokan kenapa tayangan Uya Memang Kuya jalan terus, kata dia, karena disukai masyarakat luas. “Kami memunculkan narasumber, tanpa pretensi negatif. Kami ingin menjadikan itu sebagai tontonan yang menghibur,” terang Uya.
sumber : www.poskota.co.id Read More..
Uya menegaskan tak ada yang sempurna dalam kehidupan ini. Termasuk dalam pembuatan dan penayangan program Uya Memang Kuya. Maka itu, begitu datang kritik kalau program tersebut kental dengan unsur magic dan qhibah, langsung diresponnya.
“Terima kasih adanya kritik tersebut. Sebisa mungkin kami akan memberikan perhatian khusus. Ya, harapannya, tentu saja bisa lebih baik dari sebelumnya. Apalagi, setelah menerima penghargaan dari Panasonic Global Award 2011 kemarin,” ungkap Uya, panjang lebar.
Untuk tidak melanggar rambu-rambu, Uya Kuya siap berdialog dengan pihak siapa saja. “Saya cuma ingin tayangan Uya Memang Kuya bisa jalan terus. Tentu saja dengan manfaat yang lebih positif. Jadi, bukan sekadar menghibur,” tegasnya.
Patokan kenapa tayangan Uya Memang Kuya jalan terus, kata dia, karena disukai masyarakat luas. “Kami memunculkan narasumber, tanpa pretensi negatif. Kami ingin menjadikan itu sebagai tontonan yang menghibur,” terang Uya.
sumber : www.poskota.co.id Read More..
Edan! Satu Kelas Hamil Bareng!
 MASSACHUSETTS (Pos Kota) – Sungguh edan! Sebanyak 17 remaja putri yang belum genap 17 tahun kompak hamil bareng.Mereka masih terdaftar sebagai siswi di Gloucester High School (setara SMU) di negara bagian Massachusetts, Amerika Serikat, menjalankan ide dari buah kesepakatan sekelas yaitu hamil secara bersamaan.
MASSACHUSETTS (Pos Kota) – Sungguh edan! Sebanyak 17 remaja putri yang belum genap 17 tahun kompak hamil bareng.Mereka masih terdaftar sebagai siswi di Gloucester High School (setara SMU) di negara bagian Massachusetts, Amerika Serikat, menjalankan ide dari buah kesepakatan sekelas yaitu hamil secara bersamaan.Tidak hanya pejabat dan guru-guru, para orangtua pun tak mengerti apa sebenarnya yang ada dalam benak dan keingingan dari ke-17 remaja putri ini.
Konon ide hamil bareng itu berawal dari menikmati liburan musim panas, ketika pulang dan mulai belajar kembali di sekolah diketahui 17 siswi hamil secara bersamaan.
Uniknya dan hebohnya mereka tak hanya satu sekolah, ketujuh belas gadis berusia kurang dari 16 tahun ini ternyata juga satu kelas!
Hingga saat ini pejabat setempat masih menyelidiki berapa umur ‘si ayah’ dan siapa saja ‘si ayah’ yang mengamili mereka. “Jika diketahui usia ‘para ayah’ ini lebih dari 20 tahun, maka mereka bisa dijatuhi hukuman penjara karena di dakwa berhubungan seks dengan anak di bawah umur,” kata seorang staf di sekolah itu.
Dari laporan yang terungkap ternyata niatan hamil secara bersama dari ke-17 siswi ini memang sedah mereka rencanakan. Bahkan diketahui nyaris siswi di kelas itu telah sepakat, namun yang benar-benar hamil hanya 17 remaja putri.
“Entah apa tujuannya, tapi dari hasil tes kehamilan yang dilakukan oleh pihak sekolah, kami menemukan fenomena menyedihkan ini. Bahkan beberapa diantara siswi lainnya ada yang mengungkapkan rasa kecewanya karena mereka gagal hamil,” ujar staf sekolah itu.
Bisa jadi ide gila ini dilatar belakangi peristiwa yang seringkali terjadi di Gloucester High School. Pasalnya, setiap usai liburan sekolah, pihak sekolah selalu mengadakan tes kehamilan bagi seluruh siswinya.
Hal ini dilakukan karena tercatat setiap tahun banyak siswinya yang tidak bisa melanjutkan sekolah karena alasan hamil di luar nikah.Namun 17 siswi yang hamil bersama kali ini benar-benar mengejutkan sehingga menjadi perbincangan dan pemberitaan media massa.
Di Indonesia hamil sebelum nikah masih dinyatakan aib. Di sebagian besar AS juga begitu. Tapi buat kelas sableng ini, hamil sebelum nikah dianggap trendy dan keren.
sumber : www.poskota.co.id Read More..
Arema Tahan Imbang Shandong 1-1
MALANG (Pos Kota) – Arema Indonesia meraih poin pertamanya di ajang Liga Champions Asia setelah menahan imbang Shandong Luneng 1-1 di Stadion Kanjuruhan, Kepanjen, Malang, Jawa Timur Selasa (5/4) sore. Arema yang sempat tertinggal 0-1, berhasil menyamakan kedudukan melalui gol Muhammad Fakhrudin dari titik penalti saat injury time.
Sedangkan gol tim tamu dicetak pada menit ketujuh dari gol Manuel de Brito. Setelah tertinggal, Arema mencoba bangkit dengan tampil lebih agresif, dan menciptakan beberapa peluang emas untuk menyamakan kedudukan.
Dalam kondisi menekan, Arema nyaris kebobolan lagi karena blunder kiper Achmad Kurniawan. Pada menit ke-50 misalnya, Shandong nyaris mencetak gol setelah mendapat tendangan bebas di luar kotak penalti, tangkapan Kurniawan terlepas. Namun, kemelut tersebut bisa diatasi Arema.
Menit ke-54, Shandong kembali mengancam lewat tandukan Manuel de Brito. Bola dari sepak pojok bisa diraih Brito yang berdiri bebas tanpa kawalan. Namun, tandukannya melebar di atas mistar gawang Arema.
Sembilan menit menjelang bubuaran, Kurniawan kembali melakukan blunder karena salah mengantisipasi backpass defender Arema. Bola menggelinding lemah ke belakang kiper Kurniawan yang nyaris saja melewati garis gawang Arema. Beruntung bola bisa diantisipasi.
Di masa injury-time, Shandong melakukan kecerobohan dengan menjatuhkan striker Arema Yongki Aribowo di kotak penalti. Wasit menunjuk titik putih, dan Fakhrudin yang dipercaya sebagai algojo, sukses melaksanakan tugasnya, 1-1. Dengan hasil ini, tidak lagi mempengaruhi posisi Arema yang berada di klasemen Grup G karena sudah menelan kekalahan dua kali.
sumber : www.poskota.co.id Read More..
Sedangkan gol tim tamu dicetak pada menit ketujuh dari gol Manuel de Brito. Setelah tertinggal, Arema mencoba bangkit dengan tampil lebih agresif, dan menciptakan beberapa peluang emas untuk menyamakan kedudukan.
Dalam kondisi menekan, Arema nyaris kebobolan lagi karena blunder kiper Achmad Kurniawan. Pada menit ke-50 misalnya, Shandong nyaris mencetak gol setelah mendapat tendangan bebas di luar kotak penalti, tangkapan Kurniawan terlepas. Namun, kemelut tersebut bisa diatasi Arema.
Menit ke-54, Shandong kembali mengancam lewat tandukan Manuel de Brito. Bola dari sepak pojok bisa diraih Brito yang berdiri bebas tanpa kawalan. Namun, tandukannya melebar di atas mistar gawang Arema.
Sembilan menit menjelang bubuaran, Kurniawan kembali melakukan blunder karena salah mengantisipasi backpass defender Arema. Bola menggelinding lemah ke belakang kiper Kurniawan yang nyaris saja melewati garis gawang Arema. Beruntung bola bisa diantisipasi.
Di masa injury-time, Shandong melakukan kecerobohan dengan menjatuhkan striker Arema Yongki Aribowo di kotak penalti. Wasit menunjuk titik putih, dan Fakhrudin yang dipercaya sebagai algojo, sukses melaksanakan tugasnya, 1-1. Dengan hasil ini, tidak lagi mempengaruhi posisi Arema yang berada di klasemen Grup G karena sudah menelan kekalahan dua kali.
sumber : www.poskota.co.id Read More..
Gempa 7,1 SR, Ribuan Warga Mengungsi

Cilacap, Padek—Gempa berpotensi tsunami berkekuatan 7,1 skala Richter (SR) mengguncang Cilacap, Jawa Tengah, kemarin (4/4), sekitar pukul 03.06 WIB. Ribuan warga Cilacap dan sekitarnya, panik dan langsung mengungsi ke daerah tinggi seperti Bandara Tunggul Wulung dan Jeruk Legi. Bahkan, seorang pengungsi meninggal diduga akibat serangan jantung.
Badan Penanggulangan Bencana Daerah (BPBD) Kabupaten Cilacap menginformasikan dampak gempa yang dirasakan warga Cilacap ini tidak menimbulkan kerusakan infrastruktur. ”Belum ada laporan kerusakan infrastruktur. Satu orang pengungsi yang pingsan di perjalanan meninggal dunia dalam perawatan di rumah sakit.
Diduga dia meninggal dunia karena serangan jantung,” ujar Kepala BPBD Kabupaten Cilacap, Wasi Aryadi kemarin.
Wakil Bupati Cilacap, Tatto Suwarto Pamuji menjelaskan tidak ada tsunami di Cilacap. Berdasarkan pengamatannya, warga Cilacap sudah tahu tempat-tempat mengungsi ketika diumumkan gempa berpotensi tsunami. ”Kita bersyukur tsunami tidak terjadi. Lebih dari itu, kejadian kemarin menjadi bukti jika pengetahuan warga akan tsunami semakin meningkat. Mereka mengungsi mengikuti jalur evakuasi. Para pejabat pemkab tidak ikut mengungsi dan membantu mengatur menenangkan warga,” terang dia.
Wakil Bupati Cilacap, Tatto Suwarto Pamuji menjelaskan tidak ada tsunami di Cilacap. Berdasarkan pengamatannya, warga Cilacap sudah tahu tempat-tempat mengungsi ketika diumumkan gempa berpotensi tsunami. ”Kita bersyukur tsunami tidak terjadi. Lebih dari itu, kejadian kemarin menjadi bukti jika pengetahuan warga akan tsunami semakin meningkat. Mereka mengungsi mengikuti jalur evakuasi. Para pejabat pemkab tidak ikut mengungsi dan membantu mengatur menenangkan warga,” terang dia.
Dampak informasi tsunami juga membuat ribuan nelayan Cilacap tidak melaut. Mereka memilih menunggu untuk memastikan laut benar-benar aman. ”Kita takut saat berangkat tsunami datang. Apalagi di laut ikannya juga sedikit. Kami lebih baik menunggu dulu,” ujar Janto, 45, di Pandanarang kemarin.
Ribuan warga pesisir selatan juga menyingkir dari rumahnya beberapa menit setelah Cilacap diguncang gempa. Warga yang panik berlari menjauh ke arah utara menggunakan berbagai kendaraan seperti sepeda motor, truk dan kendaraan pribadi. Bahkan, tidak sedikit warga terpaksa menggunakan sepeda atau jalan kaki.
Warga Pangandaran Panik
Dampak gempa juga dirasakan warga Pantai Pangadaran, Jawa Barat. Bayangan tsunami tahun 2006 melanda Pantai Pangandaran dan merenggut ratusan nyawa masih membekas di warga pantai selatan Ciamis tersebut. Ribuan warga dan wisatawan panik dan pergi menuju tempat yang tinggi.
Berdasarkan pantauan di lapangan, warga dan wisatawan langsung berhamburan ke luar rumah. Dalam hitungan detik setelah gempa, hampir semua ruas jalan dipenuhi warga dan wisatawan. Titik sentral kerumunan warga berada di kawasan Bunderan Pangandaran, tepatnya di depan Masjid Al Istoqomah yang berjarak 2 kilometer dari bibir pantai.
sumber : padangekspres Read More..
Takut Gempa, Turis Asing Tinggalkan Pangandaran
BANDUNG (Pos Kota) – Belasan turis asing yang sedang berwisata di Pantai Pangandaran, Jawa Barat, Selasa, mendadak ‘kabur’ menyusul adanya gempa berkekuatan 7,1 SR, Senin kemarin. Mereka rencanya akan menikmati idahnya Pangandaran selama sepekan, ternyata memilih balik menuju Jakarta karena ketakutan adanya gempa susulan lebih besar lagi.
” Semua turis asing sudah pada pulang. Mereka membatalkan belibur di Pangandaran lebih lama karena adanya gempa Senin kemarin. Saat ini turus asing kosong,” kata sejumlah pengusaha hotel, di Pangandara, Selasa.
Dedi,45, pengusaha hotel di Pantai Timur Pangandaran, saat dihubungi melalui telepon, menyebutkan, pulangnya turis asing itu disebabkan adanya gempa berkekuatan 7,1 SR Senin subuh lalu. ” Turis yang menginap di hotel kami ada delapan orang. Mereka sudah pulang padahal baru menginap satu hari. Alasannya, takut ada gempa susulan,” kata Dedi.
Mudiknya turis dari Pangandaran bukan saja dialami Dedi, melainkan pengusaha hotel lainnya mengalami nasib sama. Beladan turis asal Eropa yang tiba di Pangandaran Minggu, Selasa ini langsung pulang setelah terjadi gempa. Alasan mereka, kata sederhana, khawatir terjadi gempa susulan yang kekuatannya lebih besar dan berpotensi tsunami seperti terjadi di Pangandaran beberapa tahun silam. ” Kami tak bisa melarang, mereka lebih memilih menyelamatkan diri dan mengantisipasi kemungkinan buruk. Rata-rata mereka pulang ke Jakarta,” katanya. (dono/B)
sumber : poskota Read More..
” Semua turis asing sudah pada pulang. Mereka membatalkan belibur di Pangandaran lebih lama karena adanya gempa Senin kemarin. Saat ini turus asing kosong,” kata sejumlah pengusaha hotel, di Pangandara, Selasa.
Dedi,45, pengusaha hotel di Pantai Timur Pangandaran, saat dihubungi melalui telepon, menyebutkan, pulangnya turis asing itu disebabkan adanya gempa berkekuatan 7,1 SR Senin subuh lalu. ” Turis yang menginap di hotel kami ada delapan orang. Mereka sudah pulang padahal baru menginap satu hari. Alasannya, takut ada gempa susulan,” kata Dedi.
Mudiknya turis dari Pangandaran bukan saja dialami Dedi, melainkan pengusaha hotel lainnya mengalami nasib sama. Beladan turis asal Eropa yang tiba di Pangandaran Minggu, Selasa ini langsung pulang setelah terjadi gempa. Alasan mereka, kata sederhana, khawatir terjadi gempa susulan yang kekuatannya lebih besar dan berpotensi tsunami seperti terjadi di Pangandaran beberapa tahun silam. ” Kami tak bisa melarang, mereka lebih memilih menyelamatkan diri dan mengantisipasi kemungkinan buruk. Rata-rata mereka pulang ke Jakarta,” katanya. (dono/B)
sumber : poskota Read More..
Langganan:
Komentar (Atom)